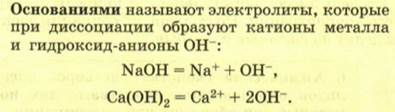


3. Составлять уравнения реакций ионного обмена, понимать их сущность.
1.Записать молекулярное уравнение реакции
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
2.С помощью таблицы растворимости определить растворимость каждого вещества.
р р н р
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl
3.Составляем полное ионное уравнение. Сильные электролиты записывают в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записывают в виде молекул.
3Na+ + 3OH- + Fe3+ + 3Cl- = Fe(OH)3 + 3Na+ + 3Cl-
4.Найти одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сократить их слева и справа.
3Na + + 3OH- + Fe3+ + 3 Cl - = Fe(OH)3 + 3Na+ + 3Cl -
5.Составить сокращенное ионное уравнение (выпишите знаки, формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH- = Fe(OH)3
4. Составлять уравнения реакций, характеризующих химические свойства кислот, оснований, оксидов и солей в молекулярном и ионном виде.
Определять окислители и восстановители, отличать окислитель – восстановительные реакции от других типов реакций, расставлять коэффициенты в окислительно – восстановительных реакциях методом электронного баланса
| Алгоритм расстановки коэффициентов |
1.Указываем степени окисления химических элементов. 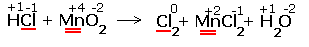 Подчёркнуты химические элементы, в которых изменились степени окисления. Подчёркнуты химические элементы, в которых изменились степени окисления. |
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов. 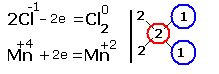 За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение: За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. Перед HCl коэффициент 2 не ставим, а считаем число атомов хлора в продуктах реакции. Оно равно - 4.Следовательно и перед HCl ставим - 4,уравниваем число атомов водорода и кислорода справа, поставив перед H2O коэффициент - 2. В результате получится химическое уравнение: 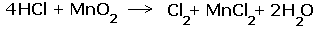 |
 2015-06-04
2015-06-04 12639
12639