6.3.1. Пусть электролиз происходит в растворе Fe(NO3)2; I = 2 A; τ = 40 мин; BТ = 35 %; анод – растворимый из железа.
Чтобы определить наличие в растворе заряженных частиц, записываем уравнение диссоциации соли и уравнение реакции гидролиза:
Fe(NO3)2 = Fe2+ + 2(NO3)  ;
;
Fe(NO3)2 + 2H2O = Fe(OH)2 + 2HNO3;
Fe2+ + 2H2O = Fe(OH)2 + 2H+, pH < 7.
На катоде происходит восстановление, т.е. принятие электронов. Так как электроны это отрицательно заряженные частицы, то из записанных выше реакций принять электроны могут Fe2+ и Н+.
На аноде происходит окисление, т.е. отдача электронов. Отдавать электроны могут частицы (NO3)  , полярные молекулы Н2О, а также сам материал анода – Fe. Бóльшей способностью к отдаче электронов обладает металл (Fe). Металлы являются восстановителями, так как в их кристаллической решетке содержится большое количество свободных электронов.
, полярные молекулы Н2О, а также сам материал анода – Fe. Бóльшей способностью к отдаче электронов обладает металл (Fe). Металлы являются восстановителями, так как в их кристаллической решетке содержится большое количество свободных электронов.
Исходя из рассмотренного, укажем молекулы и ионы, которые могут разряжаться на аноде и катоде. Следует при этом учитывать, что число принятых и отданных электронов должно быть одинаковым.
(–) Катод (+) Анод
← Fe2+ → H2O
← H+ → (NO3) 
→ Fe0
Fe2+ + 2 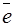 = Fe0
= Fe0
2H+ + 2 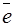 = H2 2Fe0 - 4
= H2 2Fe0 - 4 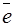 = 2Fe2+.
= 2Fe2+.
6.3.2. Водный раствор Fe(NO3)2 (нерастворимый анод, например Pt).
Проанализируем, какие изменения произошли в системе. В вышеприведенном перечне элементов для катода и анода теперь отсутствует Fe0, а Pt как нерастворимый электрод только пропускает через себя электроны. Следовательно, катодные реакции сохраняются прежними, а на аноде конкурируют Н2О и (NO3)  . Для простейшего объяснения следует иметь в виду, что частица (NO3)
. Для простейшего объяснения следует иметь в виду, что частица (NO3)  имеет более сложную структуру, чем Н2О, поэтому на аноде электроны будет отдавать кислород воды. То же самое будет происходить, если в вашем варианте задания окажется не нитратная соль, а сульфат, например, FeSO4, то в этом случае тоже разрядке подвергается Н2О, а не (SO4)2-.
имеет более сложную структуру, чем Н2О, поэтому на аноде электроны будет отдавать кислород воды. То же самое будет происходить, если в вашем варианте задания окажется не нитратная соль, а сульфат, например, FeSO4, то в этом случае тоже разрядке подвергается Н2О, а не (SO4)2-.
Если в предложенном варианте используются галогениды, то учитывая, что Н2О по структуре сложнее, в анодной реакции отдавать электроны будут галогениды, например: 2Cl  – 2
– 2 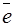 → Cl
→ Cl 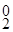 .
.
Записываем реакции на аноде и катоде для раствора Fe(NO3)2 с нерастворимым анодом:
(–) Катод (+) Анод (нерастворимый)
← Fe2+ → H2O
← H+ → (NO3) 
Fe2+ + 2 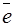 = Fe0
= Fe0
2H+ + 2 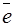 = H2 2H2O - 4
= H2 2H2O - 4 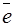 = O2 + 4H+.
= O2 + 4H+.
На катоде восстановление водорода возможно при малых значениях перенапряжения (η) на данном металле. При необходимости используются табличные данные.
6.3.3. Расплав Fe(NO3)2 (растворимый анод Fe0).
В расплаве происходит диссоциация:
Fe(NO3)2 = Fe2+ + 2(NO3)  .
.
Ввиду отсутствия воды гидролиз не происходит и ионы Н+ не образуются.
(–) Катод (+) Анод
← Fe2+ → (NO3) 
→ Fe0
Fe2+ + 2 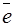 → Fe0 Fe0 - 2
→ Fe0 Fe0 - 2 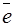 → Fe2+.
→ Fe2+.
Таким образом, при электролизе следует учитывать следующие закономерности:
а) на аноде происходит процесс окисления, поэтому в первую очередь должны реагировать более сильные восстановители – вещества, имеющие наиболее отрицательные значения потенциалов;
б) на катоде происходит процесс восстановления, поэтому в первую очередь должны реагировать более сильные окислители – вещества, имеющие наиболее положительные значения потенциалов.
Расчет массы Fe (m), выделившегося на катоде, проводим по формуле, отражающей закон Фарадея:
m (Fe) = α · I · τ · BТ,
α = 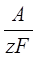 ,
,
где α – электрохимический эквивалент вещества,
А – атомная масса металла;
z – его валентность;
F – число Фарадея (96500 Кл/моль);
I – сила тока,
τ – время электролиза в секундах;
ВТ – выход по току вещества,
ВТ = 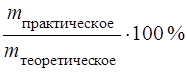 .
.
Тогда масса железа, выделившегося на катоде, рассчитывается следующим образом:
m (Fe) = 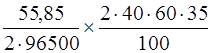 = 0,486 г.
= 0,486 г.
Таким образом, выделяется 0,486 г железа.
Таблица VI.1
| Номер варианта | Схемы окислительно-восстановительных реакций |
MnSO4 + Na2SO4 + H2O + Cl2  MnO2 + NaCl + H2SO4 MnO2 + NaCl + H2SO4 | |
HMnO4 + Pb(NO3)2 + H2O  PbO2 + Mn(NO3)2 + HNO3 PbO2 + Mn(NO3)2 + HNO3 | |
MnSO4+Br2+К2SO4+K2SO4 + H2O  KMnO4 + КBr + H2SO4 KMnO4 + КBr + H2SO4 | |
K2SO4 + I2 + NO2 + H2O  KI + HNO3 + H2SO4 KI + HNO3 + H2SO4 | |
K2SO4 + Cr2(SO4)3 + H2O  K2Cr2O7 + H2SO4 + SO2 K2Cr2O7 + H2SO4 + SO2 | |
Al +K2Cr2O7 + H2SO4  Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O Al2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O | |
KClO3 + FeSO4 + H2SO4  KCl + Fe2(SO4)3 + H2O KCl + Fe2(SO4)3 + H2O | |
K2Cr2O7 + KI + H2SO4  Cr2(SO4)3 + I2 + K2SO4 + H2O Cr2(SO4)3 + I2 + K2SO4 + H2O | |
KMnO4 + HCl  KCl + Cl2 + MnCl2 + H2O KCl + Cl2 + MnCl2 + H2O | |
K2Cr2O7 + H2S + H2SO4  Cr2(SO4)3 + S + K2SO4 + H2O Cr2(SO4)3 + S + K2SO4 + H2O | |
FeCl2 + KMnO4 + HCl  FeCl3 + MnCl2 + KCl + H2O FeCl3 + MnCl2 + KCl + H2O | |
K2Cr2O7 + H2SO4 + FeSO4  K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O K2SO4 + Cr2(SO4)3 + Fe2(SO4)3 + H2O | |
Ti2(SO4)3+ KMnO4+ H2SO4  Ti(SO4)2 + MnSO4 + K2SO4 + H2O Ti(SO4)2 + MnSO4 + K2SO4 + H2O | |
FeSO4 + HNO3 + H2SO4  Fe2(SO4)3 +NO+ H2O Fe2(SO4)3 +NO+ H2O | |
NaNO2 + NaI + H2SO4  NO + I2 + Na2SO4 + H2O NO + I2 + Na2SO4 + H2O | |
KI + KNO2 + H2SO4  I2 + K2SO4 + NO + H2O I2 + K2SO4 + NO + H2O | |
Cu + HNO3  Cu(NO3)2 + NO + H2O Cu(NO3)2 + NO + H2O | |
K2Cr2O7 + HCl  Cl2 + CrCl3 + KCl + H2O Cl2 + CrCl3 + KCl + H2O | |
CuS + HNO3  S + NO + Cu(NO3)2 + H2O S + NO + Cu(NO3)2 + H2O | |
Mg + H2SO4  H2S + MgSO4 + H2O H2S + MgSO4 + H2O | |
K2S + KMnO4 + H2SO4  S + MnSO4 + K2SO4 + H2O S + MnSO4 + K2SO4 + H2O | |
I2 + Cl2 + H2O  HCl + HIO3 HCl + HIO3 | |
KBr + K2Cr2O7 + HCl  Br2 + CrCl3 + KCl + H2O Br2 + CrCl3 + KCl + H2O | |
Zn + KMnO4 + H2SO4  ZnSO4 + MnSO4 + K2SO4 + H2O ZnSO4 + MnSO4 + K2SO4 + H2O | |
K2Cr2O7 + KI + H2SO4  Cr2(SO4)3 + I2 + K2SO4 + H2O Cr2(SO4)3 + I2 + K2SO4 + H2O | |
MnO2 + HCl  MnCl2 + Cl2 + 2H2O MnCl2 + Cl2 + 2H2O | |
K2Cr2O7 + NaNO2 + H2SO4  Cr2(SO4)3+NaNO3+H2O+K2SO4 Cr2(SO4)3+NaNO3+H2O+K2SO4 | |
Ag + HNO3  AgNO3 + H2O + NO2 AgNO3 + H2O + NO2 | |
PbS + HNO3  S + NO + Pb(NO3)2 + H2O S + NO + Pb(NO3)2 + H2O | |
NaNO2 + NaI + H2SO4  I2 + NO↑ + H2O I2 + NO↑ + H2O |
Таблица VI.2
| Номер варианта | Металлы | Концентрация ионов металла, моль/л |
| Cu,Ag | 0,01 | |
| Cu,Au | 0,1 | |
| Cu,Al | 0,001 | |
| Cu,Zn | 0,01 | |
| Cu,Ni | 0,1 | |
| Mg,Al | 0,001 | |
| Mg,Fe | 0,01 | |
| Mg,Zn | 0,1 | |
| Mg,Co | 0,001 | |
| Mg,Au | 0,01 | |
| Ni,Fe | 0,1 | |
| Ni,Co | 0,001 | |
| Ni,Al | 0,01 | |
| Ni,Sn | 0,1 | |
| Ni,Cd | 0,001 | |
| Fe,Co | 0,01 | |
| Fe,Al | 0,1 | |
| Fe,Pb | 0,001 | |
| Fe,Sn | 0,01 | |
| Fe,Au | 0,1 | |
| Co,Al | 0,001 | |
| Co,Au | 0,01 | |
| Al,Zn | 0,1 | |
| Sn,Mg | 0,001 | |
| Pb,Cu | 0,01 | |
| Mn,Al | 0,1 | |
| Mn,Cr | 0,001 | |
| Sb,Pd | 0,01 | |
| In,Sn | 0,1 | |
| In,Zn | 0,001 |
Таблица VI.3
| Номер варианта | Формула соли | I, A | t, мин | ВТ, % масс. |
| CuCl2 | ||||
| ZnSO4 | 2,5 | |||
| SnCl2 | 2,8 | |||
| Cr2(SO4)3 | 1,5 | |||
| MnCl2 | 3,5 | |||
| FeSO4 | 3,2 | |||
| ZnCl2 | 4,1 | |||
| CrCl3 | 3,6 | |||
| MnSO4 | 1,9 | |||
| NiSO4 | 4,2 | |||
| NiCl2 | 3,3 | |||
| CoCl2 | 1,4 | |||
| CoSO4 | 1,7 | |||
| Zn(NO3)2 | 1,9 | |||
| Co(NO3)2 | 1,8 | |||
| Fe(NO3)2 | 2,4 | |||
| CuBr2 | 2,7 | |||
| ZnI2 | 2,2 | |||
| CrBr3 | 3,4 | |||
| MnI2 | 4,0 | |||
| AgNO3 | 5,1 | |||
| FeI2 | 6,2 | |||
| MnCl2 | 3,6 | |||
| Cr(SO4)3 | 4,1 | |||
| Cu(NO3)2 | 2,7 | |||
| CdCl2 | 3,5 | |||
| Pb(NO3)2 | 2,4 | |||
| SbCl3 | 2,6 | |||
| PdSO4 | 4,0 | |||
| InCl3 | 1,8 |
Список литературы
1. Коровин Н.В. Общая химия. – М.: Высш. шк., 2000. – 558 с.
2. Фролов В.В. Химия. – М.: Высш. шк., 1986. – 541 с.
3. Ахметов Н.С. Общая и неорганическая химия. – М.: Высш. шк., 2001. – 743 с.
4. Романцева Л.М., Лещинская З.Л. Сборник задач и упражнений по общей химии. – М.: Высш. шк., 1991. – 288 с.
5. Контрольные задания по курсу химии /Амирханова Н.А., Попов В.И., Белоногов В.А. и др.
– Уфа: УГАТУ, 2000. – 52 с.
6. Лабораторные работы по химии /Под ред. Н.А. Амирхановой. – Уфа: УГАТУ, 1999. – 292 с.
7. Сборник задач по химии /Под ред. Н.А. Амирхановой. – Уфа: УГАТУ, 2002. – 112 с.
 2015-06-05
2015-06-05 982
982







