Химическое строение и свойства. Витамин С был выделен в 1928 г., но связь между заболеваемостью цингой и недостатком витамина была доказана только в 1932 г. Витамин С является гамма-лактоном, близким по структуре к глюкозе. Его молекула имеет два ассимметрических атома углерода (4С и 5С) и четыре оптических изомера. Биологически активна только L-аскорбиновая кислота. Аскорбиновая кислота образует редокс-пару с дегидроаскорбиновой кислотой, сохраняющей витаминные свойства.
Водные растворы аскорбиновой кислоты быстро окисляются в присутствии кислорода даже при комнатной температуре. Скорость деградации возрастает с повышением температуры, при увеличении рН раствора, под действием УФ-лучей, в присутствии солей тяжелых металлов. Аскорбиновая кислота разрушается в процессе приготовления пищи и хранения продуктов.
Суточная потребность витамина C. В организме человека, обезьян, морских свинок, индийской плотоядной летучей мыши и некоторых птиц витамин С не синтезируется. В пищевом рационе человека аскорбиновая кислота должна присутствовать постоянно, так как она быстро расходуется, а ее избыток уже через 4 часа полностью выводится из организма.
Источником витамина С служит растительная пища. Особенно богаты им перец и черная смородина, далее идут укроп, петрушка, капуста, щавель, цитрусовые, земляника, но чемпионом среди всех растений является шиповник: 1,2 г (!) на 100 г сухих ягод. Для профилактики цинги следует ежесуточно получать 50 мг аскорбиновой кислоты, однако наиболее оптимальной для здорового человека вне стрессовой ситуации является доза 100—200 мг в сутки; при заболеваниях она может быть увеличена до 2-х г в сутки.
Метаболизм витамина C. Аскорбиновая кислота всасывается путем простой диффузии на всем протяжении желудочно-кишечного тракта, но преимущественно это происходит в тонком кишечнике. В крови и тканях она связывается с различными высокомолекулярными соединениями белковой и небелковой природы. Дегидроаскорбиновая кислота, образующаяся в клетках из аскорбиновой кислоты ферментом аскорбатоксидазой, является неустойчивым соединением и легко окисляется в водной фазе с образованием 2,3-дикетогулоновой кислоты, которая уже не обладает витаминной активностью. Восстановление дегидроаскорбиновой кислоты в аскорбиновую осуществляется дегидроаскорбатредуктазой с участием глутатиона-SH. Конечными продуктами деградации витамина С являются щавелевая, треоновая, ксилоновая и ликсоновая кислоты. Аскорбат и продукты его распада экскретируются с мочой.
Биохимические функции витамина C. Витамин С занимает доминирующее положение во внеклеточной антиоксидантной защите, значительно превосходящее в этом отношении глутатион-SH. Он является также важнейшим внутриклеточным антиоксидантом. Антиоксидантная функция аскорбиновой кислоты объясняется ее способностью легко отдавать два атома водорода, используемых в реакциях обезвреживания свободных радикалов. В высоких концентрациях этот витамин «гасит» свободные радикалы кислорода. Важной функцией аскорбата является обезвреживание свободного радикала токоферола (витамина Е), благодаря чему предупреждается окислительная деструкция этого главного антиоксиданта клеточных мембран. Как антиоксидант аскорбиновая кислота необходима для образования активных форм фолиевой кислоты, защиты железа гемоглобина и оксигемоглобина от окисления, поддержания железа цитохромов Р450 в восстановленном состоянии. Витамин С участвует во всасывании железа из кишечника и высвобождении железа из связи его с транспортным белком крови — трансферрином, облегчая поступление этого металла в ткани. Он может включаться в работу дыхательной цепи митохондрий, являясь донором электронов для цитохрома С.
Очень важную роль играет аскорбат в реакциях гидроксилирования:
*Гидроксилирование «незрелого» коллагена, осуществляемое пролингидроксилазой с участием витамина С, ионов железа, α-кетоглутарата и кислорода. В этой реакции α-кетоглутарат окисляется до сукцината и СO2, один атом кислорода включается в сукци-нат, другой — в ОН-группу оксипролина. ОН-группы оксипролина участвуют в стабилизации структуры, формируя водородные связи между цепями триплетной спирали зрелого коллагена. Витамин С нужен также для образования оксилизина в коллагене. Остатки оксилизина в коллагене служат для образования участков связывания с полисахаридами.
*Гидроксилирование триптофана в 5-гидрокситриптофан (в реакции синтеза серотонина).
*Реакции гидроксилирования при биосинтезе гормонов корковой и мозговой части надпочечников.
*Гидроксилирование р-гидроксифенилирувата в гомогентизиновую кислоту.
*Гидроксилирование бета-бутиробетаина при биосинтезе карнитина.
Витамин С активно участвует в обезвреживании токсинов, антибиотиков и других чужеродных для организма соединений, осуществляемых оксигеназной системой цитохромов Р450 В составе оксигеназной системы микросом витамин С играет роль прооксиданта, т. е., как и в реакциях гидроксилирования, обеспечивает образование свободных радикалов кислорода (так называемое Fe2+-аскорбатстимулируемое ПОЛ, т. е. перекисное окисление липидов). Взаимодействие аскорбата с ионами железа или меди в присутствии пероксида водорода вызывает мощный прооксидантный эффект, поскольку при этом образуется гидроксильный радикал (ОН), инициирующий реакции ПОЛ.
Усиление прооксидантного действия витамина С приводит к нежелательным последствиям, особенно в условиях «перегрузки» организма железом.
В плазме крови и тканях ионы железа и меди находятся в связи с транспортными и депонирующими белками (церулоплазмином, трансферрином, ферритином и др.), которые препятствуют бесконтрольному развитию свободнорадикальных цепных реакций, катализируемых этими металлами и аскорбиновой кислотой. Помимо белков (в плазме крови), эту роль может на себя брать мочевая кислота (в цереброспинальной жидкости) или восстановленный глутатион (в синовиальной жидкости). Однако основным антиоксидантом. препятствующим прооксидантному действию витамина С, является витамин Е. Необходимо подчеркнуть, что выраженный антиоксидантный эффект аскорбата проявляется только при совместном его введении с токоферолом, поскольку именно витамин Е способен эффективно устранять свободные радикалы жирных кислот и их перекиси, образующиеся в реакциях Fe2+-аскорбатстимулируемого ПОЛ.
Таким образом, аскорбиновая кислота стабилизирует витамин Е, который легко разрушается, а витамин Е усиливает антиоксидантное действие витамина С. Помимо токоферола синергистом действия аскорбата является витамин А.
Витамин С является антиканцерогеном не только в силу его антиоксидантных свойств, но и в силу способности непосредственно предотвращать нитрозаминовый канцерогенез (эти сильные канцерогены образуются в кислой среде желудка из нитритов и аминосоединений пиши). Однако аскорбат не защищает от влияния уже образовавшихся нитрозаминов, поэтому консервированные мясные продукты необходимо употреблять с овощами и зеленью, богатыми витамином С.
Гиповитаминоз витамина C. Дефицит витамина С приводит к заболеванию цингой (скорбутом). Главным симптомом цинги является нарушение проницаемости капилляров, обусловленное недостаточностью гидроксилирования пролина и лизина в коллагене, и нарушение синтеза хондроинтинсульфатов. Мышечная слабость является следствием быстро развивающейся недостаточности карнитина, обеспечивающего энергетику миоцитов. При гиповитаминозе С развивается железодефицитная анемия из-за нарушения всасывания железа и использования его запасов при синтезе гемоглобина. При недостатке аскорбата снижается также участие фолиевой кислоты в пролиферации костномозговых клеток.
Гиповитаминоз Свсегда сопровождается ослаблением иммунозащитных сил организма, а также усилением реакций свободнорадикального окисления, лежащих в основе патогенеза множества заболеваний — лучевой болезни, рака, атеросклероза. диабета и др.
4.2 Витамин В1 (тиамин). Антиневритный витамин
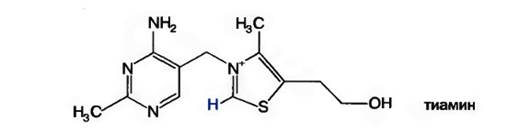
Химическое строение и свойства. Витамин В1, был первым витамином, выделенным в кристаллическом виде К. Функом в 1912 г. Позже был осуществлен его химический синтез. Свое название — тиамин — получил из-за наличия в составе его молекулы атома серы и аминогруппы. Тиамин состоит из 2-х гетероциклических колец — аминопирими-динового и тиазолового. Последнее содержит каталитически активную функциональную группу — карбанион (относительно кислый углерод между серой и азотом).
Тиамин хорошо сохраняется в кислой среде и выдерживает нагревание до высокой температуры. В щелочной среде, например при выпечке теста с добавлением соды или карбоната аммония, он быстро разрушается.
Суточная потребность, пищевые источники. Довольно много витамина В1, содержится в пшеничном хлебе из муки грубого помола, в оболочке семян хлебных злаков, в сое, фасоли, горохе. Много его в дрожжах, меньше — в картофеле, моркови, капусте. Из продуктов животного происхождения наиболее богаты тиамином печень, нежирная свинина, почки, мозг, яичный желток. В настоящее время дефицит витамина В1, становится одной из проблем питания, так как из-за высокого потребления сахара и кондитерских изделий, а также белого хлеба и шлифованного риса существенно увеличивается расход этого витамина в организме. Использовать дрожжи в качестве источника витамина не рекомендуется из-за высокого содержания в них пуринов, что может приводить к возникновению обменного артрита (подагры).
Суточная потребность в тиамине 1,1 - 1,5 мг.
Биохимические функции. Витамин В1, в форме ТПФ (тиаминпирофосфата) является составной частью ферментов, катализирующих реакции прямого и окислительного декарбоксилирования кетокислот.Участие ТПФ в реакциях декарбоксилирования кетокислот объясняется необходимостью усиления отрицательного заряда углеродного атома карбонила кетокислоты в переходном, нестабильном, состоянии:
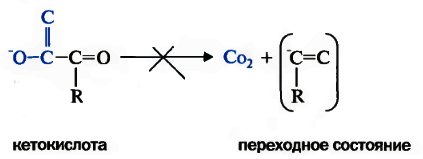
Переходное состояние стабилизируется ТПФ путем делокализации отрицательного заряда карбаниона тиазолового кольца, играющего роль своеобразного электронного стока. Вследствие такого протонирования образуется активный ацетальдегид (гидроксиэтил-ТПФ).
Аминокислотные остатки белков обладают слабой способностью осуществлять то, что с легкостью делает ТПФ, поэтому апобелки нуждаются в коферменте. ТПФ жестко связан с апоферментом мультиферментных комплексов дегидрогеназ α-оксикетокислот.
1. Участие ТПФ в реакции прямого декарбоксилирования пировиноградной кислоты (ПВК). При декарбоксилировании ПВК с помощью пируватдекарбоксилазы образуется ацетальдегид, который под воздействием алкогольдегидрогеназы превращается в этанол. ТПФ является незаменимым кофактором пируватдекарбоксилазы. Этим ферментом богаты дрожжи.
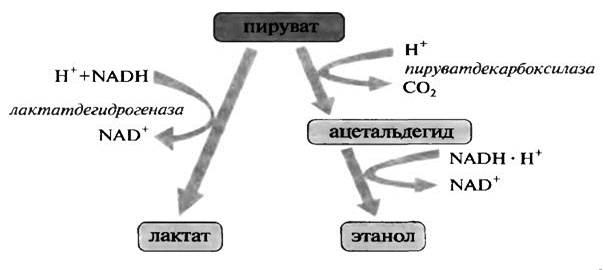
2.Участие ТПФ в реакциях окислительного декарбоксилирования.
Окислительное декарбоксилирование ПВК катализирует пируватдегидрогеназа. В состав пируватдегидрогеназного комплекса входит несколько структурно связанных ферментных белков и коферментов. ТПФ катализирует начальную реакцию декарбоксилирования ПВК. Эта реакция идентична катализируемой пируватдекарбоксилазой. Однако в отличие от последней, пируватдегидрогеназа не превращает промежуточный продукт гидроксиэтил-ТПФ в ацетальдегид. Вместо этого гидроксиэтильная группа переносится к следующему ферменту в мультиферментной структуре пируватдегидрогеназного комплекса.
Окислительное декарбоксилирование ПВК является одной из ключевых реакций в обмене углеводов. В результате этой реакции ПВК, образовавшаяся при окислении глюкозы, включается в главный метаболический путь клетки — цикл Кребса, где окисляется до углекислоты и воды с выделением энергии. Таким образом, благодаря реакции окислительного декарбоксилирования ПВК создаются условия для полного окисления углеводов и утилизации всей заключенной в них энергии. Кроме того, образующаяся при действии ПДГ-комплекса активная форма уксусной кислоты служит источником для синтеза многих биологических продуктов: жирных кислот, холестерина, стероидных гормонов, ацетоновых тел и других.
Окислительное декарбоксилирование α-кетоглутатарата катализирует α-кетоглутаратдегидрогеназа. Этот фермент является составной частью цикла Кребса. Строение и механизм действия α-кетоглугарат-дегидрогеназного комплекса схожи с пируватдегидрогеназой, т. е. ТПФ также катализирует начальный этап превращения кетокислоты. Таким образом, от степени обеспеченности клетки ТПФ зависит бесперебойная работа этого цикла.
Помимо окислительных превращений ПВК и α-кетоглутарата, ТПФ принимает участие в окислительном декарбоксилировании кетокислот с разветвленным углеродным скелетом (продукты дезаминирования валина, изолейцина и лейцина). Эти реакции играют важную роль в процессе утилизации аминокислот и, следовательно, белков клеткой.
3.ТПФ-кофермент транскетолазы. Транскетолаза — фермент пентозофосфатного пути окисления углеводов. Физиологическая роль этого пути заключается в том, что он является основным поставщиком NADFH*H+ и рибозо-5-фосфата. Транскетолаза переносит двууглеродные фрагменты от ксилулозо-5-фосфата к рибозо-5-фосфату,
что приводит к образованию триозофосфата (3-фосфоглицеринового альдегида) и 7С сахара (седогептулозо-7-фосфата). ТПФ необходим для стабилизации карбаниона, образующегося при расщеплении связи С2— С3 ксилулозо-5-фосфата.
4. Витамин В1 принимает участие в синтезе ацетилхолина, катализируя в пируватдегидрогеназной реакции образование ацетил-КоА — субстрата ацетилирования холина.
5. Помимо участия в ферментативных реакциях, тиамин может выполнять и некоферментные функции, конкретный механизм которых еще нуждается в уточнении. Полагают, что тиамин участвует в кроветворении, на что указывает наличие врожденных тиаминзависимых анемий, поддающихся лечению высокими дозами этого витамина, а также в стероидогенезе.
Гиповитаминоз. Недостаток в пище тиамина приводит к значительному накоплению пировиноградной и α-кетоглутаровой кислот, снижению активности тиаминзависимых ферментов в крови и тканях организма.
Экспериментально доказано, что тиаминовая недостаточность сопровождается нарушением структуры и функции митохондрий. Добавление к последним ТПФ нормализует тканевое дыхание.
Особая чувствительность нервной ткани к недостатку тиамина объясняется тем, что коферментная форма этого витамина абсолютно необходима нервным клеткам для усвоения глюкозы, которая является для них почти единственным источником энергии (большинство других клеток организма может использовать иные энергетические вещества, например жирные кислоты).
Гипервитаминоз не описан. Избыток принятого витамина быстро выводится с мочой. Оценка обеспеченности организма тиамином. С этой целью обычно определяют содержание витамина и/или его коферментов в эритроцитах крови. Поскольку при недостатке витамина В1 нарушается окислительное декарбоксилирование кетокислот, увеличение содержания в крови и моче пировиноградной и α-кетоглутаровой кислот будет свидетельствовать о недостатке тиамина в организме. Однако следует иметь в виду, что накопление пирувата отмечается не только при ги-
повитаминозе В1, но и при гипоксии и других патологических состояниях.
Наилучшим способом судить о степени обеспеченности организма витамином В1, является определение активности тиаминзависимых ферментов. Однако активность пируват- и α-кетоглутаратдегидогеназ снижается только при глубоком гиповитаминозе, поскольку их апофермент прочно связывает ТПФ.
Транскстолаза связывает ТПФ слабее и активность ее в эритроцитах начинает снижаться уже на ранних стадиях гиповитаминоза В1. Если к образцу крови добавить ТПФ, то величина возрастания активности транскетолазы (так называемый ТПФ-эффект) позволит судить о степени недостаточности тиамина.
4.3 Витамин В2 (рибофлавин)
Химическое строение и свойства. Витамин В2 отличается от других витаминов желтым цветом iflavus — желтый). Однако, в отличие от окисленной желтой, восстановленная форма витамина бесцветна.
Рибофлавин впервые был выделен из кисломолочной сыворотки. Синтезирован Р. Куном в 1935 г. Молекула рибофлавина состоит из гетероциклического изоаллок-сазинового ядра, к которому присоединен в 9-м положении спирт рибитол (производное D-рибозы).
Биосинтез флавинов осуществляется растительными и многими бактериальными клетками, а также плесневыми грибками и дрожжами. Благодаря микробному биосинтезу рибофлавина в желудочно-кишечном тракте жвачные животные не нуждаются в этом витамине. У других животных и человека синтезирующихся в кишечнике флавинов недостаточно для предупреждения гиповитаминоза. Витамин В2 хорошо растворим в воде, устойчив в кислой среде, но легко разрушается в нейтральной и щелочной, а также под действием видимого и УФ-облучения.
Суточная потребность,пищевые источники витамина B2. Суточная потребность ввитамине 1-3 мг. Основными источниками рибофлавина являются печень, почки, желток куриного яйца, творог. В кислом молоке витамина содержится больше, чем в свежем. В растительных продуктах витамина В2 мало (исключение - миндальные орехи). Частично дефицит рибофлавина восполняется кишечной микрофлорой.
Метаболизм витамина B2. В пише витамин В2 находится преимущественно в составе своих коферментных форм, связанных с белками — флавопротеинов. Под влиянием пищеварительных ферментов витамин высвобождается и всасывается путем простой диффузии в тонком кишечнике. В энтероцитах рибофлавин фосфорилируется до FMN (флавин-моно-нуклеотида) и FAD (флавин-адениндинуклеотида). Реакции протекают следующим образом:
• 5-ОН-группа боковой цепи фосфорилируется флавокиназой
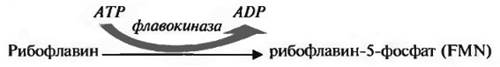
• FMN с помошью фосфатных связей соединяется с аденозин-монофосфатом при участии фермента пирофосфорилазы.

Аналогичные реакции протекают в клетках крови, печени и других тканей.
 2015-06-26
2015-06-26 7872
7872
