Фермент Е обратимо соединяется с субстратом S, образуя нестойкий промежуточный фермент-субстратный комплекс ES, который в конце реакции распадается с освобождением фермента и продуктов реакции Р.
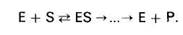
Эти представления легли в основу теории «ключа-замка» Э. Фишера (1890), которую иногда называют теорией «жесткой матрицы». Структура активного центра комплементарна молекулярной структуре субстрата, обеспечивая тем самым высокую специфичность фермента. В образовании фермент-субстратных комплексов участвуют водородные связи, электростатические и гидрофобные взаимодействия, а в ряде случаев также ковалентные, координационные связи.
Д. Кошлендом была разработана теория «индуцированного соответствия» (1958). Пространственное соответствие структуры субстрата и активного центра фермента создается в момент их взаимодействия друг с другом («перчатка — рука»). Субстрат индуцирует конформационные изменения молекулы фермента таким образом, что активный центр принимает необходимую для связывания субстрата пространственную ориентацию. Т.е. фермент только в момент присоединения субстрата будет находиться в активной (напряженной) Т-форме (tensile) в отличие от неактивной R-формы (relaxe). Конформационные перестройки в ферменте в процессе изменения его активности Кошленд сравнивал с колебаниями паутины, когда в нее попала добыча (субстрат). Между ферментом и субстратом существует пространственная или геометрическая комплементарность и электростатическое соответствие. Для каталитической активности фермента существенное значение имеет пространственная структура, в которой жесткие участки α-спиралей чередуются с гибкими, эластичными линейными отрезками, обеспечивающими динамические изменения белковой молекулы фермента. Присоединение субстрата к активному центру фермента в случае их комплементарности приводит к формированию активного комплекса. В противном же случае формируется неактивный комплекс.
В настоящее время гипотеза Кошланда постепенно вытесняется гипотезой топохимического соответствия. Сохраняя основные положения теории «индуцированного соответствия», она объясняет специфичность действия ферментов узнаванием той части субстрата, которая не изменяется при катализе. Предполагается индуцирование изменений в молекуле субстрата при его взаимодействии с ферментом.
Подобно другим катализаторам, ферменты, с термодинамической точки зрения, ускоряют химические реакции за счет снижения энергии активации. Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное состояние при данной температуре. Как катализируемая ферментом, так и не катализируемая им реакция имеет одинаковую величину стандартного изменения свободной энергии (ΔG). Однако ферментативная реакция имеет более низкую энергию активации. Действуя на скорость реакции, ферменты не изменяют положения равновесия между прямой и обратной реакциями, а лишь ускоряют его наступление.
Ферментативная кинетика исследует влияние химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температура, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Скорость ферментативной реакции (V) измеряют по убыли количества субстрата или приросту продукта за единицу времени.
При ферментном катализе фермент (Е) обратимо соединяется с субстратом (S), образуя нестойкий фермент-субстратный комплекс (ES), который в конце реакции распадается с освобождением фермента (Е) и продуктов реакции (Р):
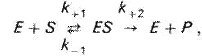
График зависимости скорости ферментативной реакции от концентрации субстрата имеет вид гиперболы.
При низкой концентрации субстрата скорость реакции прямо пропорциональна его концентрации (участок а графика) иопределяется уравнением:
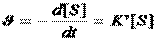
При высокой концентрации субстрата, когда все молекулы фермента находятся в форме фермент-субстратного комплекса, достигается полное насыщение активных центров фермента субстратом, а скорость реакции становится максимальной (Vmax) (участок в).
При полунасыщении, когда половина молекул фермента находится в форме ES, скорость реакции равна половине максимальной (участок б).
Скорость химической реакции, ускоряемой ферментом (как и скорость обычной химической реакции),
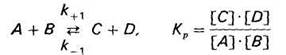
v+1 = k+1 [А][В]; v−1 = k−1 [С][D].
K-1 – константа скорости обратной реакции,
K+1 – константа скорости прямой реакции.
В состоянии равновесия v+1 = v−1, тогда k+1[А][В] = k−1[С] [D].
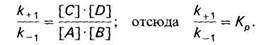
Константа диссоциации фермент-субстратного комплекса KS – величина, обратная константе равновесия.
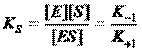
Ksзависит от химической природы субстрата и фермента и определяет степень их сродства. Чем ниже значение Ks, тем выше сродство фермента к субстрату.
Л. Михаэлис и М. Ментен вывели уравнение, названное уравнением Михаэлиса – Ментен. Оно выражает количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:
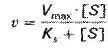
Vmax — величина, постоянная для каждого фермента, которая позволяет оценить эффективность его действия.
Уравнение Михаэлиса-Ментен не учитывает влияние на скорость ферментативного процесса продуктов реакции.
Поэтому было предложено уравнение Бриггса – Холдейна:
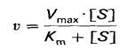
где Кm – экспериментально определяемая константа Михаэлиса:
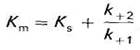
Кривая этого уравнения – гиперболическая зависимость V от концентрации S.
Константа Михаэлиса численно равна концентрации субстрата, при которой скорость ферментативной реакции составляет половину от Vmax. Кm показывает сродство фермента к субстрату; чем меньше ее значение, тем больше сродство. Экспериментальные значения Кmдля большинства ферментативных реакций с участием одного субстрата обычно 10-2-10-5 М.
Изоферменты могут различаться по значению Кm. Для изоферментов глюкокиназы и гексокиназы, катализирующих реакцию фосфорилирования глюкозы, значение Кm различается в 50 раз.
Если реакция обратима, то взаимодействие фермента с субстратом прямой реакции характеризуется Кm, отличающейся от таковой для субстрата обратной реакции. Например, карбоангидраза для СО2 имеет Кm, равную 1,2.10-2 М, а для НСО3- Кm больше и равна 2,6.10-2 М.
В случае множественных форм ферментов и аллостерической природы фермента кинетическая кривая имеет не гиперболическую форму, а сигмоидный характер. Это означает, что связывание одной молекулы субстрата в одном каталитическом центре повышает связывание субстрата с другим центром, т. е. имеет место кооперативное взаимодействие (кислород с гемоглобином).
Г. Лайнуивер и Д. Бэрк преобразовали уравнение Бриггса – Холдейна и получили уравнение прямой линии: у = ах + b.
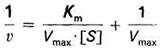
Метод Лайнуивера – Берка дает более точный результат.
 2015-06-26
2015-06-26 1649
1649
