Цель работы:
1. Исследовать видимую часть спектра атома водорода.
2. Определить постоянную Ридберга и энергию ионизации атома водорода.
Основные теоретические положения работы.
Законы классической физики описывают непрерывные процессы. Атом, состоящий из положительно заряженного ядра и окружающих его электронов, согласно этим законам, будет находиться в равновесии только при условии, что электроны непрерывно движутся вокруг ядра по некоторым орбитам. Но с точки зрения классической электродинамики движущиеся с ускорением электроны излучают электромагнитные волны, вследствие чего они теряют энергию и постепенно падают на ядро. В этих условиях частота обращения электрона меняется непрерывным образом и спектр излучения атома должен быть сплошным. Когда электрон упадет на ядро, атом перестает существовать.
Несложными вычислениями можно убедиться в том, что промежуток времени, через который электрон упадет на ядро, составляет 10-11с. Эксперимент показывает, что атомные спектры состоят из отдельных линий или групп линий. Все это указывает на то, что процессам, в которых участвуют микрообъекты, свойственна прерывность (дискретность), и методы классической физики, вообще говоря, неприменимы к описанию внутриатомных движений.
В 1913 году Н.Бору удалось построить непротиворечивую теорию, которая успешно объясняла строение атома водорода. Бор распространил Постулат М.Планка (1900г.) о существовании устойчивых стационарных состояний осцилляторов (который является необходимой предпосылкой для вывода правильной формулы излучения абсолютно черного тела) на любые атомные системы. В основе теории Бора лежат два постулата:
1. Атом и атомные системы могут длительно пребывать только в определенных (стационарных) состояниях, в которых, несмотря на происходящие в них движения заряженных частиц, они не излучают и не поглощают энергию. В этих состояниях атомные системы обладают энергиями, образующими дискретный ряд: Е1, Е2, …, Еn. Состояния эти характеризуются своей устойчивостью: всякое изменение энергии в результате поглощения или испускания электромагнитного излучения или в результате соударения может происходить только при полном переходе (скачком) из одного состояния в другое.
2. При переходе из одного состояния в другое атомы испускают (или поглощают) излучение только строго определенной частоты. Излучение, испускаемое (или поглощаемое) при переходе из состояния с энергией Еm в состояние Еn монохроматично, и его частота определяется из условия
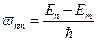 (1)
(1)
Оба постулата противоречат требованиям классической электродинамики. Первый постулат утверждает, что атомы не излучают, хотя образующие его электроны совершают ускоренное движение (обращение по замкнутым орбитам). Согласно второму постулату, испускаемые частоты не имеют ничего общего с частотами периодических движений электронов.
Спектр излучения того или иного вещества - важная его характеристика, которая позволяет установить его состав, некоторые характеристики его строения, свойства атомов и молекул.
Атомы газа испускают линейчатые спектры, состоящие из групп отдельных спектральных линий, называемых спектральными сериями. Наиболее простой спектр имеет атом водорода. Уже в 1885 году Бальмер показал, что длины волн четырех линий, лежащих в видимой части спектра, могут быть очень точно представлены эмпирической формулой
λ = В 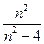 (2)
(2)
где n = 3, 4, 5, 6,…, В – эмпирическая константа.
Закономерность, выражаемая этой формулой, становится особенно наглядной, если представить ее в том виде, в котором ей обычно пользуются в настоящее время:
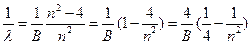 (3)
(3)
Величину 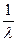 иногда обозначают через
иногда обозначают через 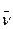 и называют спектроскопическим волновым числом. Константа
и называют спектроскопическим волновым числом. Константа 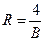 носит название постоянной Ридберга. Таким образом, окончательно получим
носит название постоянной Ридберга. Таким образом, окончательно получим
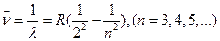 . (4)
. (4)
С увеличением номера n линии интенсивность линии уменьшается. Уменьшается также разность между волновыми числами соседних линий. При n = ∞ получается постоянное значение 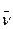 =
= 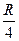 . Если схематически представить расположение спектральных линий, определяемых (4) и условно изображать длиной линии их интенсивность, получится картина, представленная на рис.1.
. Если схематически представить расположение спектральных линий, определяемых (4) и условно изображать длиной линии их интенсивность, получится картина, представленная на рис.1.
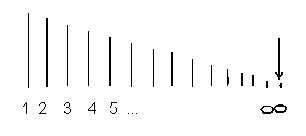
Рис.1
Совокупность спектральных линий, обнаруживающие в своей последовательности и в распределении интенсивности закономерность, показанную на рис.1, называется спектральной серией. Предельная длина волны, около которой сгущаются линии при n → ∞, называется границей серии. Серия, описываемая формулой (4) носит название серии Бальмера.
Наряду с серией Бальмера в спектре атома водорода был обнаружен ряд других серий, представляемых совершенно аналогичными формулами.
В ультрафиолетовой области была найдена серия Лаймана:
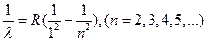 (5)
(5)
В инфракрасной области спектра были обнаружены
Серия Пашена
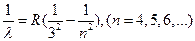 (6)
(6)
Серия Брэкета
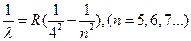 (7)
(7)
Серия Пфунда
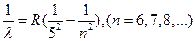 (8)
(8)
Серия Хэмфри
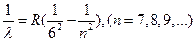 (9)
(9)
Таким образом, все известные серии атомарного водорода можно представить так называемой обобщенной формулой Бальмера:
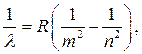 (10)
(10)
где m в каждой серии имеет постоянной значение, а n – ряд целых значений, начинающихся с m+1.
Поиски физического смысла формулы (10)привели к созданию квантовой теории атома водорода. Уравнение Шредингера для него записывается в виде:
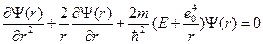 (11)
(11)
где Ψ(r) – волновая функция, описывающая состояние электрона в атоме, Е – полная энергия электрона.
Решение этого уравнения – спектр возможных значений полной энергии атома водорода:
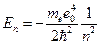 (12)
(12)
Согласно (1) частота перехода между состояниями определяется
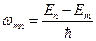 (13)
(13)
С другой стороны, по известной формуле
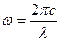 (14)
(14)
Комбинируя (12), (13) и (14), получаем:
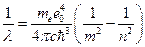 (15)
(15)
что при
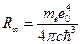 (16)
(16)
совпадает с обобщенной формулой Бальмера.
Теоретическое значение постоянной Ридберга (16) все же значительно отличается от экспериментально полученного из спектроскопических измерений. Это связано с тем, что при выводе формулы (16) принимаются два допущения: а) масса ядра атома бесконечно велика по сравнению с массой электрона (отсюда и символ «∞» в обозначении постоянной) и б) ядро неподвижно. В действительности, например, для атома водорода, масса ядра всего лишь в 1836,1 раз больше массы электрона. Учет этого обстоятельства приводит к следующей формуле:
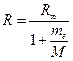 (17)
(17)
где М – масса ядра атома. В этом приближении постоянная Ридберга зависит от массы ядра, и поэтому ее значение для различных водородоподобных атомов отличаются друг от друга (рис.2).
Рис.2 Рис.3
Для того, чтобы получить всю совокупность сведений об атоме, удобно пользоваться диаграммой уровней энергии (рис.3). Горизонтальные прямые отвечают различным энергетическим состояниям атома водорода. По мере увеличения номера состояния расстояние между соседними уровнями уменьшается и в пределе обращается в нуль. Выше места слияния расположена сплошная область неквантованных положительных энергий. За нулевой уровень энергии принимается энергия уровня с n = ∞. Ниже этого значения энергетические уровни дискретны. Им соответствуют отрицательные значения полной энергии атома. Это обстоятельство указывает на то, что энергия электрона в таких состояниях меньше его энергии в том случае, когда он отделен от атома и покоится на бесконечно большом расстоянии, то есть на то, что электрон находится в связанном состоянии.
Наличие несвязанных электронов делает возможными квантовые переходы между состояниями непрерывного энергетического спектра, а также между такими состояниями и состояниями дискретного спектра энергии. Это проявляется в виде сплошного спектра испускания или поглощения, накладывающегося на линейчатый спектр атома. Поэтому спектр не обрывается на границе серии, а продолжается за нее в сторону более коротких волн, где он становится сплошным. Переходы из состояний непрерывного спектра (тех состояний, в которых атом ионизирован) в состояния дискретного спектра сопровождается рекомбинацией электрона и положительного иона. Возникающее при этом излучение называется рекомбинационным.
Переход атома из нормального состояния на более высокий энергетический уровень дискретного спектра есть возбуждение атома. Переход же атома с одного из уровней дискретного спектра в область сплошного спектра превращает атом в несвязанную систему. Это есть процесс ионизации атома. Энергия, соответствующая волновому числу начала сплошного спектра со стороны длинных волн (волновому числу границы серии) должна быть равной энергии ионизации, то есть энергии, необходимой для отделения электрона от атома и удаления его на бесконечное расстояние. Таким образом, волновое число границы серии Лаймана дает энергию ионизации атома водорода в основном, наиболее устойчивом состоянии.
В данной работе изучаются четыре первые линии серии Бальмера, которые имеют следующие обозначения:
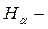 красная линия (n = 3),
красная линия (n = 3),
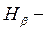 сине – голубая линия (n = 4),
сине – голубая линия (n = 4),
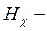 голубая линия (n = 5),
голубая линия (n = 5),
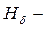 фиолетовая линия (n = 6).
фиолетовая линия (n = 6).
 2015-06-28
2015-06-28 6479
6479