Белки устойчивы в растворе, т.к. имеют заряд и гидратную оболочку. Они называются факторами устойчивости белка.
Осадить белок из раствора можно, если удалить даже один из факторов устойчивости.
16. Реакции осаждения. Как можно осадить белок из раствора? Значение этих реакций в медицине
При снятии заряда белки теряют гидратную оболочку, растворимость их падает и они выпадают в осадок, т.е. белки осаждаются, если они теряют оба или хотя бы один из факторов устойчивости.
Веществами, которые могут снять заряд белковой молекулы, являются соли тяжелых металлов, алкалоидные реактивы. Концентрированные кислоты обладают дегидратирующим свойством. Осадить белки из растворов можно и нейтральными солями. Этот процесс называется высаливанием. Высаливающее действие ионов зависит от их способности отнимать воду у белков, а также от способности ионов адсорбироваться на белковых молекулах и нейтрализовать их заряд. По силе высаливающего действия ионы образуют следующий ряд:
степень гидратации
|
|
|

степень адсорбции
Литий обладает наибольшей плотностью электрического заряда, сильно притягивает воду, следовательно, хорошо снимает гидратную оболочку, но плохо адсорбируется. Цезий, наоборот, лучше адсорбируется на поверхности белка. Высаливание используется для фракционирования и очистки белков.
17. Структурная организация белков. Зависимость биологических свойств белка от первичной структуры.
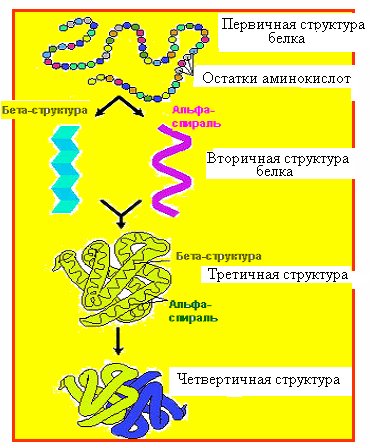
Значительное различие белковых молекул в качественном и количественном аминокислотном составе обеспечивает этому классу соединений не только высокую степень специфичности, но и исключительную сложность строения. Взаимоотношения аминокислот и пространственное расположение отдельных частей белковых молекул характеризуется четырьмя уровнями организации - первичной, вторичной, третичной и четвертичной структурами. Все белки имеют первые три уровня организации и только некоторые - четвертичную структуру.
Первичная структура - первый уровень организации белковых молекул, характеризуется последовательностью расположения, качеством и количеством соединенных между собой остатков аминокислот на всем протяжении полипептидной цепи. Эта структура обеспечивается пептидной связью.
В каждой цепи различают две концевые аминокислоты: N-концевая имеет свободную аминогруппу и считается первой, С-концевая имеет свободную карбоксильную группу и считается последней. Последовательность аминокислот в полипептидной цепи обуславливает расстановку по ее длине различных
функциональных групп.

Скелет полипептидной цепи образован аминогруппой, α-углеродом и карбоксильной группой. Боковые цепи (радикалы) аминокислот располагаются ниже или выше остова цепи. Каждый белок характеризуется уникальной первичной структурой, ее изменения ведут к нарушениям физико-химических и функциональных свойств белков. Белки различных видов животных, одинаковые в функциональном отношении, отличаются природой входящих в их состав аминокислот, т. е. белкам присуща специфичность, обусловленная их первичной структурой.
|
|
|
От первичной структуры зависят и антигенные свойства белка, обуславливающие выработку иммунной системой специфического белка (антитела) при введении в организм чужеродных белковых молекул. Антитела, соединяясь с антигеном, выводят его из метаболического круга, способствуя его осаждению, растворению и т. д. Часть белка, участвующая в образовании комплекса с антителом, называется антигенной детерминантой
Вторичная структура. Знание первичной структуры недостаточно для точного представления о строении белка и его функции. Вторичная структура — это способ свертывания, скручивания полипептидной цепи в спиральную или какую-либо иную конформацию. Возникает в результате образования большого числа водородных связей между карбонильными кислородами одной пептидной связи и азотом иминогрупп, расположенных на четыре аминокислотных остатка выше предыдущей аминокислоты (рис. 4). Таким образом, все кислородные атомы карбонильных групп и атомы азота в пептидных связях соединены водородными связями, каждая из которых является весьма слабой, но вместе они формируют достаточно стабильную спиралевидную структуру.
Различают два вида вторичной структуры: α-спираль и β-структура.
α-структура - спираль, имеющая правое вращение, на каждый шаг которой приходится 3,6 аминокислот или 0,54 нм (рис. 5. А). Период регулярности α-спирали равен 5 шагам или 18 аминокислотным остаткам. Длина одного периода составляет 2,7 нм. Направление водородных связей совпадает с продольной осью молекулы.
Второй тип - β-конфигурация характерна для некоторых фибриллярных белков (фиброин шелка) и называется слоисто-складчатой. Белковая молекула имеет форму гармошки, направление водородных связей в которой перпендикулярно продольной оси и в которой водородные связи образуются не только в пределах одной полипептидной цепи, но и между разными цепями. Нарушение вторичной структуры возможно при нагревании. Спирализация линейной полипептидной цепи уменьшает ее размер примерно в 4 раза.
 Б
Б
А
Третичная структура - общая форма или конформация (трехмерная структура) полипептидной цепи. Кроме спирали и складчатости в белках имеется и более высокий порядок пространственной организации, в осуществлении которого участвуют изгибы полипептидной цепи, обусловленные, в основном, присутствием остатков пролина, оксипролина и глицина. При этом происходит укладка полипептидной цепи с образованием плотной структуры. Возможны две формы третичной структуры - глобулярная и фибриллярная. Жесткость третичной структуры обеспечивается дисульфидными, ионными и гидрофобными связями. При образовании третичной структуры гидрофобные радикалы аминокислот вталкиваются внутрь белковой молекулы, а гидрофильные ориентируются на ее наружной поверхности. Такая конфигурация наиболее выгодна в термодинамическом отношении, т. к. характеризуется минимальной свободной энергией и поэтому наиболее стабильна. Укладка белка в третичную структуру делает молекулу белка в десятки раз более компактной, чем исходная полипептидная цепь. В третичной структуре белки, состоящие из одной полипептидной цепи, приобретают биологическую активность.
|
|
|
Третичная структура является высшей для молекул с одной полипептидной цепью.
Четвертичная структура это расположение полипептидных цепей, входящих в состав отдельных субъединиц, относительно друг друга, т.е. способ их укладки и упаковки с образованием нативной конформации белка. Такая структура характерна для белков, образованных комбинацией нескольких полипептидных цепей с формированием единого в функциональном отношении макромолекулярного комплекса. Полипептидные цепи, из которых формируется этот комплекс, называются субъединицами. Связи, стабилизирующие четвертичную структуру - ионные, водородные и дисульфидные. Первым белком, ставшим объектом рентгеноструктурного анализа, стал гемоглобин. По своей форме он приближается к сфере. Каждая из 4-х полипептидных цепей имеет характерную для нее третичную структуру. Эти цепи уложены относительно друг друга приблизительно в виде тетраэдра, в результате возникает характерная четвертичная структура. С каждой цепью связан один гем. Гемы разных цепей расположены далеко друг от друга и имеют разный угол наклона. Четвертичная структура характерна для гемоглобина, состоящего из четырех полипептидных цепей и четырех гемов, коллагена, состоящего из трех полипептидных цепей и т.д.
Наличие четвертичной структуры имеет большой биологический смысл:
1. Синтезируются небольшие полипептидные цепи, из которых собираются макромолекулы, что уменьшает количество ошибок при синтезе.
2. Экономит генетический материал, т. к. одинаковые цепи синтезируются на одной м-РНК с использованием большого числа рибосом.
3. Обуславливает возможность регуляторных воздействий. Мономерные единицы, участвующие в образовании четвертичной структуры, взаимодействуют между собой гидрофобными участками, не имеющими активных функциональных групп. Поэтому их соединение непрочное и субъединицы легко смещаются по отношению друг к другу при малейших воздействиях.
Можно отметить, что из всех структур наиболее прочная - первичная, наименее прочная - четвертичная.
|
|
|
18. Денатурация белков, денатурирующие агенты, их действие.
При образовании третичной структуры возникает неповторимая высоко специфическая форма индивидуальных белков, малейшее изменение которой сопровождается нарушением биологической активности белка, изменением его физико-химических свойств. Происходит денатурация белка. Таким образом, денатурация наблюдается в тех случаях, когда из-за разрыва связей, стабилизирующих определенные структуры, четвертичная, третичная, вторичная структуры разрушаются. Денатурацию могут вызвать следующие денатурирующие агенты:
1. Повышение температуры выше 42°С, вызывающее разрыв водородных и гидрофобных связей.
2. Кислоты и основания, изменяющие заряд и действующие на полярные связи.
3. Органические растворители, влияющие на гидрофобное взаимодействие.
4. Мочевина и гуанидин, образующие с белками многочисленные водородные связи, вследствие чего происходит дезорганизация их структуры, при этом воздействии возможна денатурация.
5. Соли тяжелых металлов, изменяющие заряд белковой молекулы и разрывающие ионные связи.
6. Ультрафиолетовое облучение.
7. Тиоловые соединения, вызывающие восстановительный разрыв дисульфидных мостиков.
Денатурирующие агенты нарушают связи, стабилизирующие третичную и даже вторичную структуру. Денатурированные белки легче расщепляются ферментами, т.к. увеличивается площадь соприкосновения фермента с пептидными связями. Денатурация может быть в некоторых случаях обратимой (при действии нейтральных солей), когда после удаления денатурирующего агента или уменьшения его концентрации, белок может восстановить свою структуру, т.е. произойдет ренатурация.
19. Классификация белков. Простые, сложные белки, определение, представители. Белки по строению делятся на две группы: простые – протеины и сложные – протеиды. Протеины состоят только из остатков аминокислот. Протеиды состоят из простого белка и простетической (небелковой) группы. Представителями простых белков являются альбумины, глобулины, гистоны, протамины, склеропротеины.
Белки
 2015-06-26
2015-06-26 20025
20025
