1. МКТ идеального газа. а) Основные положения МКТ. б) Закон Авогадро: при одинаковых давлениях и температурах равные объёмы различных газов содержат одинаковые числа молекул.
| υ = 1 моль | m | Уравнения МКТ |
| 0,012 кг С; NA = 6,02·1023 моль-1; N = NAυ; M = m0NA. M = Mr·10-3 кг/моль. Мr- по химической формуле и таблице Менделеева. | m = vM 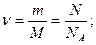 m = m0N = m0υNA. m = m0N = m0υNA. | Основное уравнение МКТ: 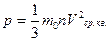 ; ; 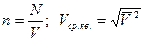 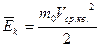 . . 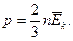 p = nkT; p = nkT; 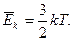 k = 1,38·10-23 Дж/К – постоянная Больцмана. T = (t0C + 273) K. k = 1,38·10-23 Дж/К – постоянная Больцмана. T = (t0C + 273) K. 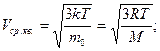 R = kNA–универс. газ. пост. R = 8,31 Дж/моль·К. R = kNA–универс. газ. пост. R = 8,31 Дж/моль·К. |
| Процесс | Постоянный параметр | Формула закона |  Графики Графики | ||||||
Закон Дальтона: p = p1 + p2 + …+ pN 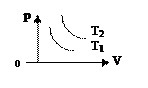 Уравнение Менделеева-Клапейрона Уравнение Менделеева-Клапейрона 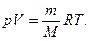 Если m = const, M = const Если m = const, M = const 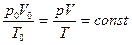 -ур. Клапейрона -ур. Клапейрона |
| ||||||||
| Изотер- мический | T=const m=const | Закон Бойля-Мариотта: pV=const; p1V1 = p2V2=const.  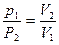 | T1, T2 – изотермы.   T2 > T1 T2 > T1 | ||||||
| Изобарный (изобари - ческий) | P=const m=const | Закон Гей-Люссака: V = V0(1 + αt);α–температурный коэффициент объёмного расширения. V = V0αT; 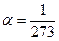 оС-1 для всех газов; оС-1 для всех газов; 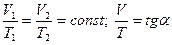 . .    |

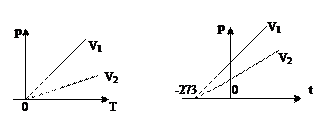 | ||||||
| Изохорный (изохори - ческий) | V = const m = const | Закон Шарля: p = p0(1+γt); γ-термический коэффициент давления. p = p0γT. 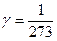 0C-1 для всех газов; 0C-1 для всех газов; 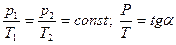 | 
|
3. ТЕРМОДИНАМИКА.
 a). Внутренняя энергия газа. U = (Wk1 + Wn1)·N. Внутренняя энергия идеального газа:
a). Внутренняя энергия газа. U = (Wk1 + Wn1)·N. Внутренняя энергия идеального газа: 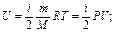 i-число степеней свободы.
i-число степеней свободы.
 Для одноатомного идеального газа i = 3; для 2-х-атомного i =5; для 3-х и более атомов i =6.
Для одноатомного идеального газа i = 3; для 2-х-атомного i =5; для 3-х и более атомов i =6.
Закон сохранения энергии. ∆ U = Aвн + Q; Aвн – работа внешних сил, Q – количество теплоты.
А вн = - А; А - работа газа. При p = const, А = p ∆V = p (V2 – V1) = νR∆T. Если V = const, A = 0.
Если Т = const, ∆U = 0, Q =A. 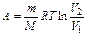 . В осях p (V) работа равна площади фигуры (для всех процессов).
. В осях p (V) работа равна площади фигуры (для всех процессов).
Первый закон термодинамики: Q = ∆U + A. Eсли Q = 0 – система теплоизолированная, происходит
адиабатный процесс; A = - ∆U (внутренняя энергия газа уменьшается), Aвн = ∆U. График – адиабата, в осях P(V) идет круче изотермы.
В замкнутой системе A = 0, Q = 0, ∆U = 0, U = const-теплообмен внутри системы. ∆U = ∆U1 +∆U2+···+∆UN = 0; ∆U1 = Q1 и так далее.
Q1+Q2+·∙∙+QN = 0 – уравнение теплового баланса. Q = cm(T2-T1) –нагревание, охлаждение; c-удельная теплоёмкость вещества;
cm = C- теплоёмкость тела. В газах “c” зависит от процесса, ср>сv; cp = cv + R / M.
Q = ± λm, + плавление, –– кристаллизация. Q = ± rm; + парообразование, - конденсация. Q = qm – сгорание топлива.
Второй закон термодинамики – направление тепловых процессов.
Тепловые двигатели. К.П.Д. тепловых двигателей 
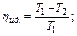
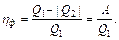 T1-температура нагревателя, T2-холодильника.
T1-температура нагревателя, T2-холодильника.

 б). Испарение, кипение, влажность, насыщенный пар – понятия. Р0-давление насыщенного пара, не зависит от V, а только Р0(T).
б). Испарение, кипение, влажность, насыщенный пар – понятия. Р0-давление насыщенного пара, не зависит от V, а только Р0(T).  Кривизна – за счёт испарения (p=nkT). Переход ненасыщенного пара в насыщенный:
Кривизна – за счёт испарения (p=nkT). Переход ненасыщенного пара в насыщенный:
1→А –изохорное охлаждение; 1→В – изотермическое сжатие;
1→С- изобарное охлаждение. Р (или ρ) – парциальное давление (или плотность) пара
в воздухе - абсолютная влажность, определяется по таблице по Тросы.
Р0 (или ρ0) – определяется по температуре воздуха.
Относительная влажность 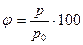 % или
% или 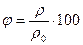 %.
%.
 Кипение. р0=рвнешнее+ρgh; т.к. р0=nkT, то nkT=pвн+ρgh; Tкип.(рвн.).
Кипение. р0=рвнешнее+ρgh; т.к. р0=nkT, то nkT=pвн+ρgh; Tкип.(рвн.).
в) Поверхностное натяжение. Fпов. - сила поверхностного натяжения, направлена вдоль поверхности жидкости, перпендикулярно линии, ограничивающей её поверхность: Fпов = σ l. Коэффициент поверхностного натяжения 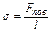 . Зависит от природы граничащих сред и Т (с увеличением Т, σ уменьшается).
. Зависит от природы граничащих сред и Т (с увеличением Т, σ уменьшается).
Понятия: смачивание, несмачивание, капиллярность. 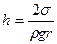 ; ρ - плотность жидкости, r- радиус капилляра, h – высота подъёма (опускания) жидкости в капилляре. Поверхностная энергия жидкости Еn = σS.
; ρ - плотность жидкости, r- радиус капилляра, h – высота подъёма (опускания) жидкости в капилляре. Поверхностная энергия жидкости Еn = σS.
 2015-07-04
2015-07-04 780
780








