МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное
Учреждение высшего профессионального образования
«Астраханский государственный университет»
(Астраханский государственный университет)
Допускается к защите
«_____»_______________ 20__ г.
Завкафедрой _________________
ДИПЛОМНАЯ РАБОТА
«Исследование влияния каптоприла на комплексообразование меди с 1,10-фенантролином»
| Выполнил(а) | |||
| студент(ка) группы | ДХМ 43 | ||
| № группы | |||
| Серова К. А. | |||
| Фамилия И.О. | |||
| руководитель | к.х.н., доцент | ||
| звание, степень, должность | |||
| Хабарова О.В. | |||
| Фамилия И.О. | |||
Астрахань – 2015
Оглавление
Введение. 4
Глава 1. Литературный обзор. 6
1.1. Общие сведения об аминокислотах. 6
1.1.1. Классификация аминокислот. 8
1.1.2. Методы качественного и количественного определения серосодержащих аминокислот. 10
1.1.3. Лекарственные средства – производные пролина и их биологическая роль 12
1.1.4. Производное цистеина – ацетилцистеин. 14
1.1.5. Антиоксидантные и антитоксические свойства ацетилцистеина. 16
1.2. Медь как комплексообразователь. 24
1.2.1. Примеры влияния поля лигандов. 24
1.2.2. Потенциалы некоторых комплексов меди. 26
1.2.3. Применение органических реагентов для определения Cu(I) 29
1.3. 1,10-Фенантролин в химико-биологических исследованиях. 31
1.3.1. Расщепление ДНК 1-10 фенантролином. 31
1.3.2. Роль Cu(II) и Н2O2 33
1.3.3. Модель присоединения комплекса 1,10-фенантролин-Cu+ к ДНК.. 34
1.3.4. Продукты реакции. 35
Глава 2.Экспериментальная часть. 37
2.1. Материалы и аппаратура. 37
2.2. Исследование оптимальных условий реакций меди(II) с. 38
1,10-фенантролином в присутствии ацетилцистеина. 38
2.2.1. Влияние рН на процесс образования комплекса медь-1,10-фенантролин в присутствии ацетилцистеина. 38
2.2.2 Влияние стабилизаторов на устойчивость комплекса во времени. 40
2.3. Определение оптимального количества ацетилцистеина для образования [Cu(Phen)2]+ 41
2.4. Влияние избытка ацетилцистеина на образование [Cu(Phen)2]+ 43
2.5. Изучение образования [Cu(Phen)2]+ в присутствии ацетилцистеина в среде калий-фосфатного буферного раствора. 44
2.6. Определения молярного коэффициента светопоглощения методом Н. П. Комаря 47
2.7. Спектрофотометрическое определение [Cu(Phen)2]+ в присутствии ацетилцистеина 50
2.8. Метод математической статистики для расчета градуировочных характеристик 52
Глава 3. Обсуждение результатов. 55
Выводы.. 60
Список использованной литературы.. 62
Глава 1. Литературный обзор
1.1. Общие сведения об аминокислотах
Аминокислоты - гетерофункциональные соединения, молекулы которых одновременно содержат аминогруппу и карбоксильную группу у одного и того же атома углерода[1].
Принцип построения аминокислот, т. е. нахождение у одного и того же атома углерода двух различных функциональных групп, радикала и атома водорода, уже сам по себе предопределяет хиральность α-атома углерода. Исключение составляет простейшая аминокислота глицин Н2N-СН2-СООН, не имеющая углеводородного радикала R и соответственно центра хиральности.
Большинство аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные аминокислоты принадлежат к L-ряду.
В твердом состоянии аминокислоты существуют в виде биполярных ионов; в водном растворе — в виде равновесной смеси биполярного иона, катионной и анионной форм. Положение равновесия зависит от рН среды. Общим для всех аминокислот является преобладание катионных форм в сильнокислых (pH 1—2) и анионных — в сильнощелочных (рH 13— 14) средах.
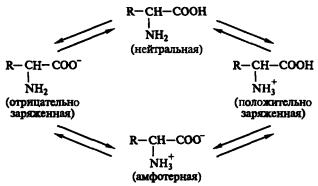
Аминокислоты представляют собой белые кристаллические вещества хорошо растворимые (за некоторым исключением) в воде, аммиаке и других полярных растворителях; в неполярных и слабополярных растворителях (метанол, этанол, ацетон) растворяются плохо. Способность аминокислот растворяться в воде является важным фактором обеспечения их биологического функционирования — с ней связаны всасываемость аминокислот, их транспорт в организме и т. п. Ионное строение обусловливает некоторые особенности аминокислот: высокую температуру плавления (выше 200 °С), нелетучесть.
Реакции по карбоксильным группам аминокислот, аминогруппа которых защищена ацилированием или солеобразованием, протекают аналогично превращениям карбоновых кислот. Аминокислоты легко образуют соли, сложные эфиры, амиды, гидразиды, азиды, тиоэфиры, галогенангидриды, смешанные ангидриды и т.д. Эфиры аминокислот под действием натрия или магнийорганических соединений превращаются в аминоспирты.
Реакции аминогрупп аминокислот аналогичны превращениям аминов. Аминокислоты образуют соли с минеральными кислотами и пикриновой кислотой, легко ацилируются хлорангидридами кислот в водно-щелочном растворе (реакция Шоттена-Баумана) и алкилируются алкилгалогенидами.
Реакции с одновременным участием групп NH2 и СООН наиболее характерны для α-аминокислот, которые способны образовывать устойчивые 5-членные гетероциклы. При взаимодействии с фосгеном α-аминокислоты превращаются в циклические ангидриды N-карбоксиаминокислот, а при нагревании с уксусным ангидридом или ацетилхлоридом - в азлактоны; нагревание аминокислоты с мочевиной или обработка изоцианатами дает гидантоины, а при использовании α-аминокислот, и особенно легко их эфиры, при нагревании превращаются в 2,5-пиперазиндионы, или дикетопиперазины [2].
Аминокислоты играют важную роль в биологических процессах организма, так как являются источником построения жизненно необходимых веществ. Из белковых гидролизатов получено более 20 α-аминокислот.
1.1.1. Классификация аминокислот
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы.
1) По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические. В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NH2), тиольная (-SH), амидная (-CO-NH2), гидроксильная (-ОН) и гуанидиновая группы.
2) Классификация аминокислот по растворимости их радикалов в воде
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные.
· Аминокислоты с неполярными радикалами. К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается.
· Аминокислоты с полярными незаряженными радикалами. Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серин, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
· Аминокислоты с ароматическими неполярными радикалами. К этой группе относят аминокислоты, имеющие в своем составе ароматические кольца (радикалы фенилаланина и триптофана).
· Аминокислоты с полярными отрицательно заряженными радикалами. К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО- и Н+. Следовательно, радикалы данных аминокислот - анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом.
· Аминокислоты с полярными положительно заряженными радикалами. Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп - отдавать протон, теряя положительный заряд радикала [3].
1.1.2. Методы качественного и количественного определения серосодержащих аминокислот
Цветные реакции для обнаружения индивидуальных аминокислот и аминокислот, входящих в состав белков, основаны на химической природе радикалов аминокислот [4].
Для открытия в биообъектах и количественного определения аминокислот успешно применяется реакция их с нингидрином. Образуется сине-фиолетовый продукт, интенсивность окраски которого (при 570 нм) пропорциональна количеству аминокислоты:
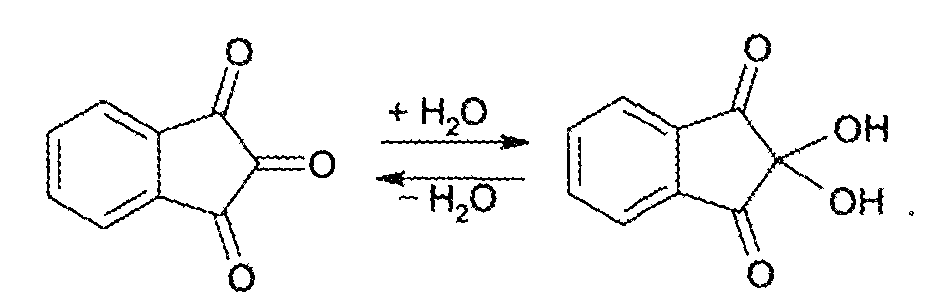
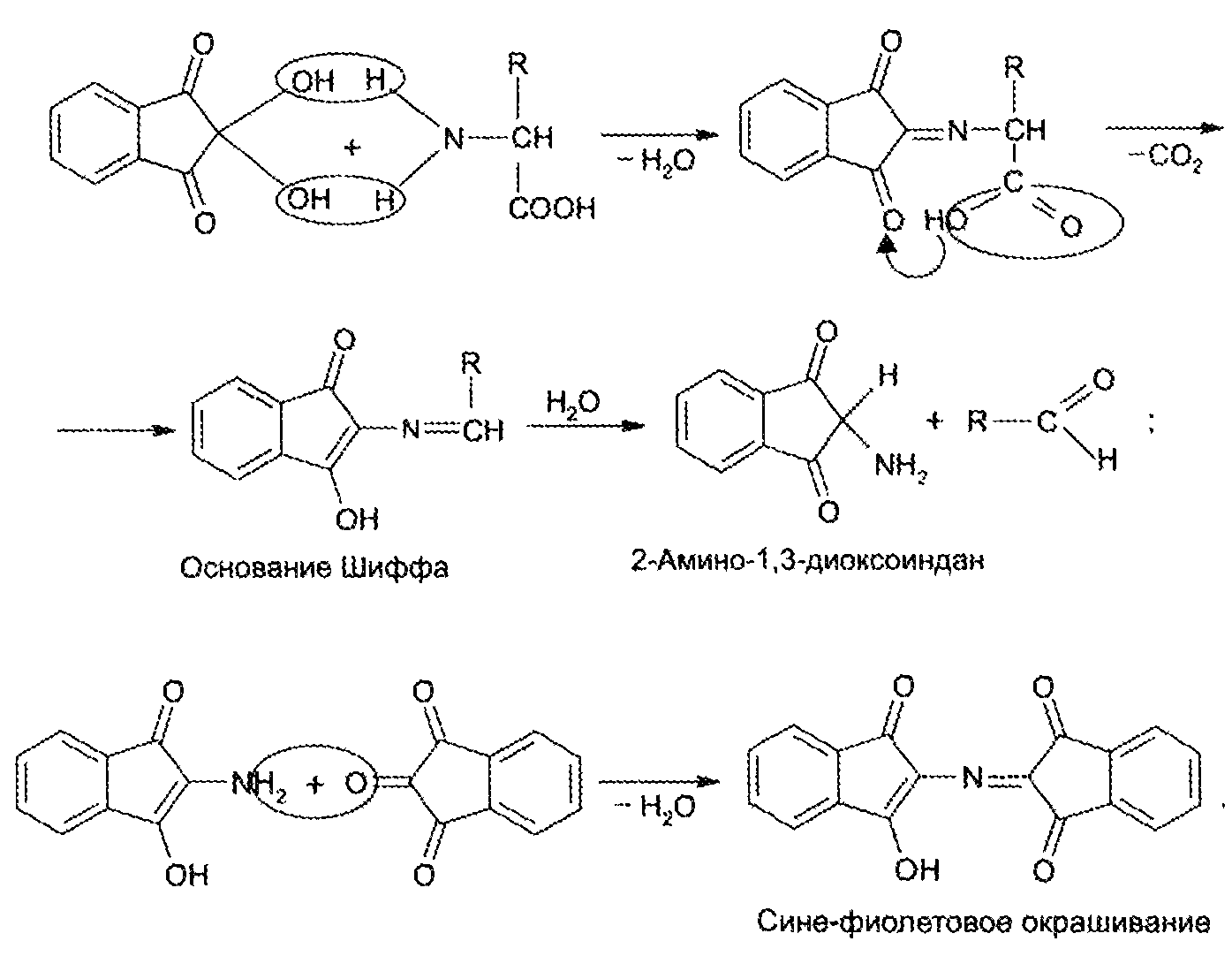
На основе нингидриновой реакции были разработаны методы количественного определения аминокислот, в частности метод распределительной хроматографии на бумаге, впервые внедренный в 1944 г. (А. Мартин и Р. Синдж).
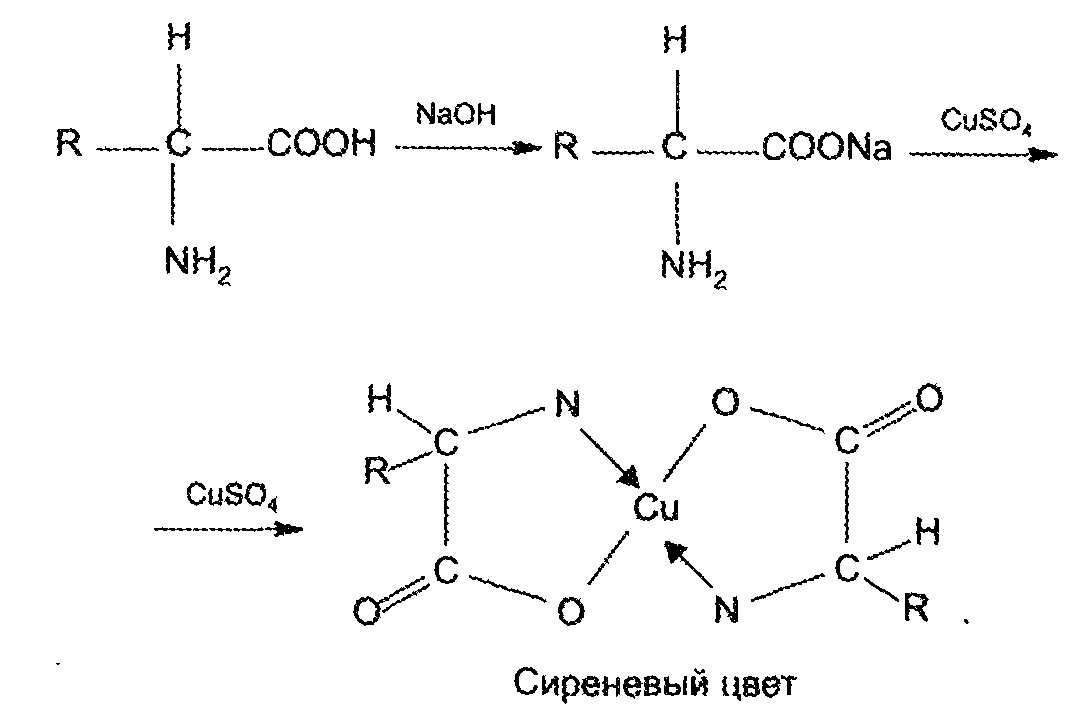
Наличием кислотных свойств обусловлены реакции комплексообразования с солями Ag+, Cu2+, Hg2+, Со2+. Групповой реакцией является реакция образования медной соли. Аминокислоту предварительно переводят в натриевую соль, избегая добавления избытка щелочи:
Так же, существует методика для определения концентраций вторичных аминов, например пирролидина, в воздухе. Метод основан на реакции пирролидина с 2,4-динитрохлорбензолом и фотометрическом определении окрашенных в желтый цвет продуктов реакции при длине волны 460 нм. Отбор проб проводится с концентрированием в поглотительный раствор.
Нижний предел измерения в фотометрируемом растворе для пирролидина - 2 мкг.
Нижний предел измерения в воздухе для пирролидина - 0,05 мг/куб. м (при отборе 80 л воздуха).
Определению мешают первичные и вторичные амины.
Суммарная погрешность не превышает +/- 20%.
Реактивы, растворы, материалы
Стандартный раствор амина N 1. В мерную колбу емкостью 25 мл вносят 15 мл 0,01 н раствора соляной кислоты, взвешивают на аналитических весах, добавляют 1 - 2 капли амина и взвешивают вторично. Содержимое колбы доводят до метки 0,01 н раствором соляной кислоты и перемешивают. По разности между вторым и первым весом определяют навеску амина и вычисляют содержание его в 1 мл раствора.
Стандартный раствор N 2, содержащий 100 мкг/мл амина, готовят соответствующим разбавлением стандарта N 1 0,01 н раствором соляной кислоты.
Кислота соляная, ч.д.а., 0,01 н и 10-процентный растворы.
Натрий углекислый безводный, ч.д.а., 8-процентный раствор.
2,4-Динитрохлорбензол, ч., 5-процентный спиртовой раствор.
Хлороформ, ч.д.а.
Спирт этиловый, х.ч.
Во все пробирки шкалы стандартов добавляют по 0,5 мл 5-процентного раствора 2,4-динитрохлорбензола и по 0,4 мл 8-процентного раствора углекислого натрия. Растворы перемешивают и ставят в кипящую водяную баню на 5 мин.
После охлаждения добавляют по 1 мл 10-процентного раствора соляной кислоты, по 2 мл хлороформа и тщательно взбалтывают. В присутствии амина нижний хлороформный слой окрашивается в желтый цвет.
Измеряют оптическую плотность хлороформного слоя на фотоэлектроколориметре при длине волны 460 нм в кюветах с толщиной поглощающего слоя 20 мм по отношению к раствору сравнения, не содержащему определяемые амины. Строят градуировочный график зависимости оптических плотностей градуировочных растворов от соответствующих им значений содержания вещества в градуировочном растворе (в мкг).
Количественное определение проводят по предварительно построенному градуировочному графику.
Расчет концентраций
Концентрацию амина в мг/куб. м воздуха "С" вычисляют по формуле:
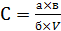
где:
а - количество амина, найденное в анализируемом объеме пробы по градуировочному графику, мкг;
б - объем пробы, взятый для анализа, мл;
в - общий объем пробы, мл;
V - объем воздуха (л), взятый для анализа и приведенный к нормальным условиям
Частные реакции
 2015-08-13
2015-08-13 2347
2347