· Основное уравнение молекулярно-кинетической теории:

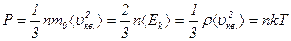
где 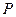 – давление газа;
– давление газа;  – концентрация молекул;
– концентрация молекул;  – общее число молекул;
– общее число молекул; 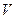 – объём;
– объём; 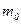 – масса одной молекулы;
– масса одной молекулы; 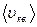 – средняя квадратичная скорость одной молекулы;
– средняя квадратичная скорость одной молекулы; 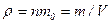 – плотность газа;
– плотность газа; 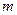 - масса газа;
- масса газа; 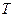 – абсолютная температура;
– абсолютная температура; 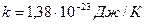 – постоянная Больцмана.
– постоянная Больцмана.
· Средняя кинетическая энергия поступательного движения одной молекулы
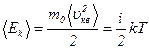 ,
,
где 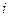 – число степеней свободы [для одноатомной молекулы
– число степеней свободы [для одноатомной молекулы 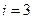 поступательным степеням; для двухатомной молекулы
поступательным степеням; для двухатомной молекулы 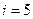 (3 поступательные и 2 вращательные); для трёхатомной молекулы
(3 поступательные и 2 вращательные); для трёхатомной молекулы 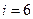 (3 поступательные и 3 вращательные)].
(3 поступательные и 3 вращательные)].
· Изопроцессы (газовые законы) – для 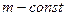 :
:
1) 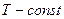 - изотермический:
- изотермический:
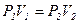 (рис.8, а, б, в)
(рис.8, а, б, в)
2) 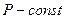 - изобарный:
- изобарный:
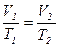 (рис. 9, а, б, в)
(рис. 9, а, б, в)
3) 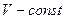 - изохорный:
- изохорный:
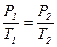 (рис.10, а, б, в)
(рис.10, а, б, в)
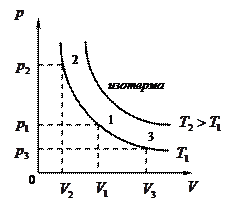
а)
 |
б) в)
Рис.8.
 |
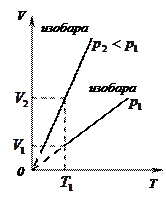
а)

 |
б) в)
Рис.9.
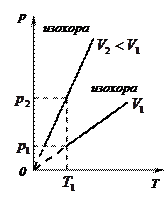
а)

 |
б) в)
Рис.10.
· Уравнение Менделеева-Клапейрона:
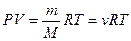 ,
,
где 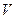 – объём газа;
– объём газа; 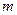 – масса газа;
– масса газа; 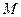 – молярная масса;
– молярная масса; 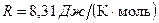 – универсальная газовая постоянная.
– универсальная газовая постоянная.
· Количество вещества (число молей):
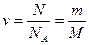 ,
,
где 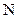 – общее число молекул;
– общее число молекул; 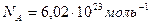 – постоянная Авогадро.
– постоянная Авогадро.
· Масса одной молекулы:
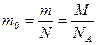 .
.
· Скорости молекул:
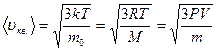 – средняя квадратичная;
– средняя квадратичная;
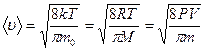 – средняя арифметическая;
– средняя арифметическая;
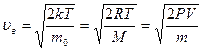 – наиболее вероятная.
– наиболее вероятная.
· Закон Максвелла для распределения молекул идеального газа по скоростям:
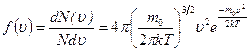 ,
,
где функция 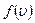 распределения молекул по скоростям определяет относительное число молекул
распределения молекул по скоростям определяет относительное число молекул 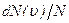 из общего числа N молекул, скорости которых лежат в интервале от
из общего числа N молекул, скорости которых лежат в интервале от 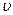 до
до 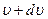 .
.
Из этой формулы следует, что
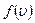 ~
~ 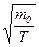 ~
~ 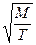 ~
~ 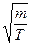 ,
,
где 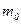 - масса одной молекулы;
- масса одной молекулы; 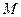 - молярная масса;
- молярная масса; 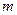 - масса газа.
- масса газа.
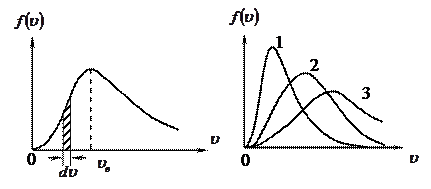
Рис.11. Рис.12
На рис.11 площадь заштрихованной полоски равна относительному числу молекул, скорости которых лежат в интервале от 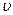 до
до 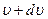 .
.
Графики на рис.12 соответствуют (при прочих равных параметрах):
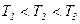 или
или 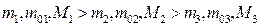 .
.
 2015-09-07
2015-09-07 266
266








