Глава 5
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Внутренняя энергия. Внутренняя энергия
идеального газа
.
Прежде чем перейти к формулировке законов термодинамики, рассмотрим сначала те понятия, на основе которых они формируются. Внутренней энергией называют энергию, которая остается у тела после вычитания из нее кинетической и потенциальной энергий как целого. С молекулярной точки зрения внутренняя энергия любой системы представляет собой среднее значение суммы энергий, входящих в нее атомов и молекул. Она складывается из средней полной кинетической энергии теплового хаотического движения молекул, потенциальной энергии межмолекулярного взаимодействия, а также из внутриатомной, внутриядерной энергии и энергии покоя частиц 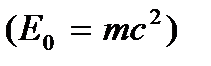 . В термодинамике энергия внутриатомного движения и энергия покоя не учитываются, так как эти составляющие внутренней энергии не изменяются и свободно не обмениваются при взаимодействиях и различных термодинамических процессах (не зависят от температуры, давления и т.д.). Поэтому в термодинамике эти части внутренней энергии полагаются равными нулю. Это означает, что внутренняя энергия отсчитывается от этих значений. Тем самым внутренняя энергия в термодинамике определяется неоднозначно, а с точностью до аддитивной постоянной, и поэтому не является измеримой величиной. Экспериментально можно измерить изменение внутренней энергии
. В термодинамике энергия внутриатомного движения и энергия покоя не учитываются, так как эти составляющие внутренней энергии не изменяются и свободно не обмениваются при взаимодействиях и различных термодинамических процессах (не зависят от температуры, давления и т.д.). Поэтому в термодинамике эти части внутренней энергии полагаются равными нулю. Это означает, что внутренняя энергия отсчитывается от этих значений. Тем самым внутренняя энергия в термодинамике определяется неоднозначно, а с точностью до аддитивной постоянной, и поэтому не является измеримой величиной. Экспериментально можно измерить изменение внутренней энергии 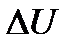 при различных процессах. Однако и измерение
при различных процессах. Однако и измерение 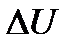 возможно не непосредственно, а косвенным путем.
возможно не непосредственно, а косвенным путем.
В статистической термодинамике в квантовом случае внутренняя энергия термодинамической системы определяется как
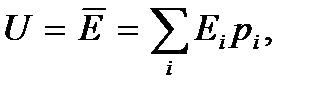 (5.1)
(5.1)
где 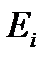 – значения уровней энергии системы,
– значения уровней энергии системы, 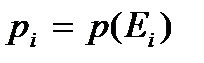 – вероятность состояния системы с энергией
– вероятность состояния системы с энергией 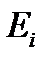 , определяемая согласно распределению Гиббса. Это выражение записано в соответствии с обычными правилами усреднения.
, определяемая согласно распределению Гиббса. Это выражение записано в соответствии с обычными правилами усреднения.
Для идеального газа, где взаимодействием молекул можно пренебречь, внутренняя энергия будет определяться средним значением суммы кинетических энергий теплового движения молекул. Учитывая, что среднее значение суммы случайных величин равно сумме средних значений этих величин, получим, что средняя энергия системы невзаимодействующих частиц будет равна сумме средних значений отдельных частиц:
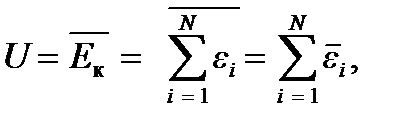
где 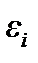 – энергия i -ой частицы. А поскольку все молекулы одинаковы, их средние энергии
– энергия i -ой частицы. А поскольку все молекулы одинаковы, их средние энергии 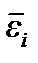 равны между собой и равны средней энергии одной молекулы
равны между собой и равны средней энергии одной молекулы 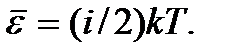 С учетом этого получаем
С учетом этого получаем
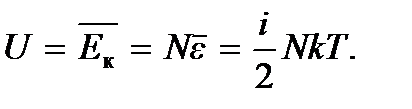 (5.2)
(5.2)
Как видим, внутренняя энергия идеального газа равна среднему значению полной кинетической энергии теплового движения молекул. Учитывая, что 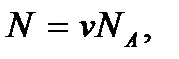 где
где 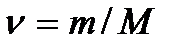 – число молей газа, и
– число молей газа, и 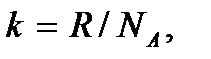 эту формулу представим в виде
эту формулу представим в виде
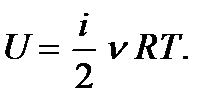 (5.3)
(5.3)
Как видим, внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема. Так и должно быть, поскольку от объема газа, а значит, от расстояния между молекулами зависит только энергия межмолекулярного взаимодействия, а этой величиной в случае идеального газа пренебрегают. Используя уравнение состояния идеального газа, формулу (5.3) можно также записать в виде
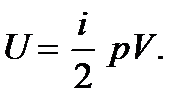
В выражение для внутренней энергии идеального газа входит число степеней свободы i. Однако эта величина на опыте непосредственно не измеряется. Обычно измеряют величину 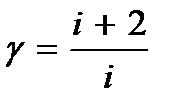 . Поэтому для расчетов внутреннюю энергию удобно выразить через измеряемую величину
. Поэтому для расчетов внутреннюю энергию удобно выразить через измеряемую величину 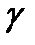 . Тогда из формулы (5.2) получим
. Тогда из формулы (5.2) получим
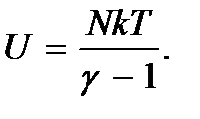
На примере идеального газа видно, что внутренняя энергия термодинамической системы является функцией ее состояния, т.е. определяется параметрами, характеризующими это состояние. При этом каждому состоянию системы соответствует одно и только одно значение энергии. Отсюда следует, что изменение внутренней энергии при переходе системы, например, из состояния 1 в состояние 2 будет равно разности ее значений в этих состояниях, независимо от способа (пути), которым совершается этот переход, т.е. 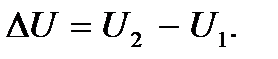 С математической точки зрения это означает, что
С математической точки зрения это означает, что 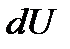 есть полный дифференциал функции
есть полный дифференциал функции 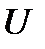 и, следовательно
и, следовательно
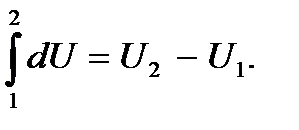
Если же имеет место круговой процесс, при котором система, пройдя ряд состояний, возвращается в исходное состояние, то система примет исходное значение энергии, так что ее изменение при этом будет равно нулю:
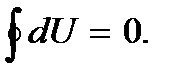
(Кружок в символе интеграла обозначает интегрирование по круговому процессу.) Если бы это было не так, то в данном состоянии энергия могла бы иметь различные значения. Это позволило бы без изменения состояния системы получить работу, равную разности энергий, что, очевидно, невозможно, так как это противоречило бы закону сохранения энергии.
 2015-09-06
2015-09-06 641
641







