Для повышения температуры различных веществ на одну и ту же величину требуется различное количество теплоты. Для того, чтобы можно было сравнивать вещества по их способности повышать температуру при подведении теплоты, пользуются указанной выше количественной мерой, называемой теплоемкостью. Из соотношения (5.6) находим 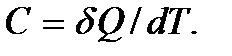 Отсюда следует, что теплоемкость – это количество теплоты, которое нужно передать веществу для его нагревания на 1 К (или на 10С). Если теплоемкость относится к единице массы вещества, ее называют удельной теплоемкостью, если к одному молю – молярной теплоемкостью. Теплоемкость зависит от условий нагревания вещества, поэтому различают теплоемкость при постоянном объеме (изохорную)
Отсюда следует, что теплоемкость – это количество теплоты, которое нужно передать веществу для его нагревания на 1 К (или на 10С). Если теплоемкость относится к единице массы вещества, ее называют удельной теплоемкостью, если к одному молю – молярной теплоемкостью. Теплоемкость зависит от условий нагревания вещества, поэтому различают теплоемкость при постоянном объеме (изохорную) 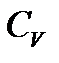 и теплоемкость при постоянном давлении (изобарную)
и теплоемкость при постоянном давлении (изобарную) 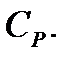 При нагревании вещества при постоянном объеме вся подводимая теплота идет на увеличение внутренней энергии вещества, а при нагревании его при постоянном давлении часть теплоты расходуется на совершение работы, поэтому
При нагревании вещества при постоянном объеме вся подводимая теплота идет на увеличение внутренней энергии вещества, а при нагревании его при постоянном давлении часть теплоты расходуется на совершение работы, поэтому 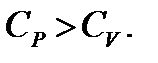 Так как при V = const работа не совершается, то
Так как при V = const работа не совершается, то 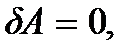 а
а 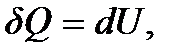 и тогда
и тогда
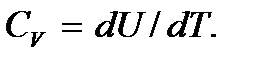
При p = const теплота 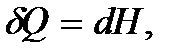 где термодинамическая функция
где термодинамическая функция 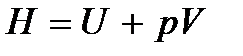 называется тепловой функцией или энтальпией. Следовательно,
называется тепловой функцией или энтальпией. Следовательно,
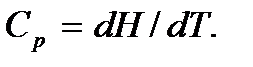
В случае идеального газа 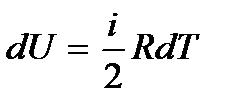 и молярная теплоемкость при постоянном объеме
и молярная теплоемкость при постоянном объеме
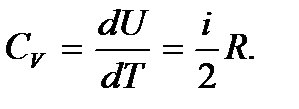 (5.13)
(5.13)
Для определения теплоемкости при постоянном давлении имеем
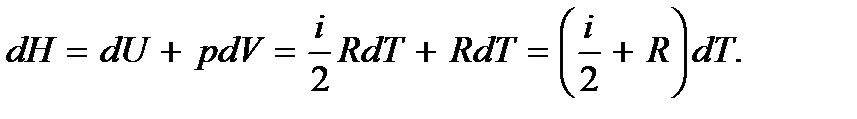
При получении этого выражения было использовано уравнение состояния идеального газа для одного моля 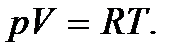 Молярная теплоемкость при постоянном давлении
Молярная теплоемкость при постоянном давлении
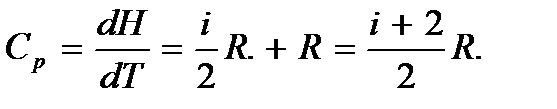
Таким образом, молярная изобарная теплоемкость газа
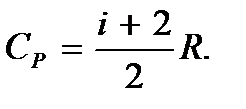 (5.14)
(5.14)
Как видим, имеет место соотношение
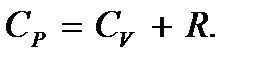
Это соотношение называется формулой Майера.
Для твердых тел и жидкостей изменение объема при изменении температуры незначительно, поэтому для таких тел 
Для идеального газа обе теплоемкости определяются только числом степеней свободы молекулы: чем больше это число, а значит, чем сложнее молекула, тем больше теплоемкость газа. Измеряя теплоемкость, можно определить число степеней свободы молекулы, а тем самым можно судить об атомной структуре молекулы и определить внутреннюю энергию газа. Это означает, что теплоемкость газа характеризует энергию теплового движения его молекул.
Отношение молярных теплоемкостей 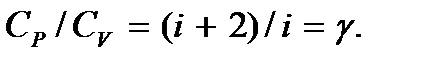 Следовательно, введенная в п. 5.1 величина
Следовательно, введенная в п. 5.1 величина 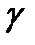 представляет собой отношение теплоемкостей газа при постоянном давлении к теплоемкости при постоянном объеме. Она определяет число степеней свободы молекулы:
представляет собой отношение теплоемкостей газа при постоянном давлении к теплоемкости при постоянном объеме. Она определяет число степеней свободы молекулы: 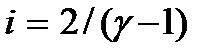 .
.
Хотя в формулы для теплоемкостей 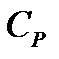 и
и 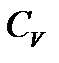 температура не входит, тем не менее зависимость обоих теплоемкостей газов от температуры существует, так как от температуры зависит число степеней свободы молекулы i. На рис. 5.4 показана зависимость изохорной теплоемкости
температура не входит, тем не менее зависимость обоих теплоемкостей газов от температуры существует, так как от температуры зависит число степеней свободы молекулы i. На рис. 5.4 показана зависимость изохорной теплоемкости 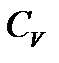 от температуры для двухатомного газа. При достаточно низких температурах молекула обладает только поступательными степенями свободы, а вращательные и колебательные степени свободы не возбуждены (или, как говорят, «заморожены»), поэтому
от температуры для двухатомного газа. При достаточно низких температурах молекула обладает только поступательными степенями свободы, а вращательные и колебательные степени свободы не возбуждены (или, как говорят, «заморожены»), поэтому 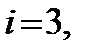 а
а 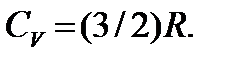 Теплоемкость остается постоянной до тех пор, пока температура не достигнет значения температуры возбуждения вращательных степеней сво-
Теплоемкость остается постоянной до тех пор, пока температура не достигнет значения температуры возбуждения вращательных степеней сво-
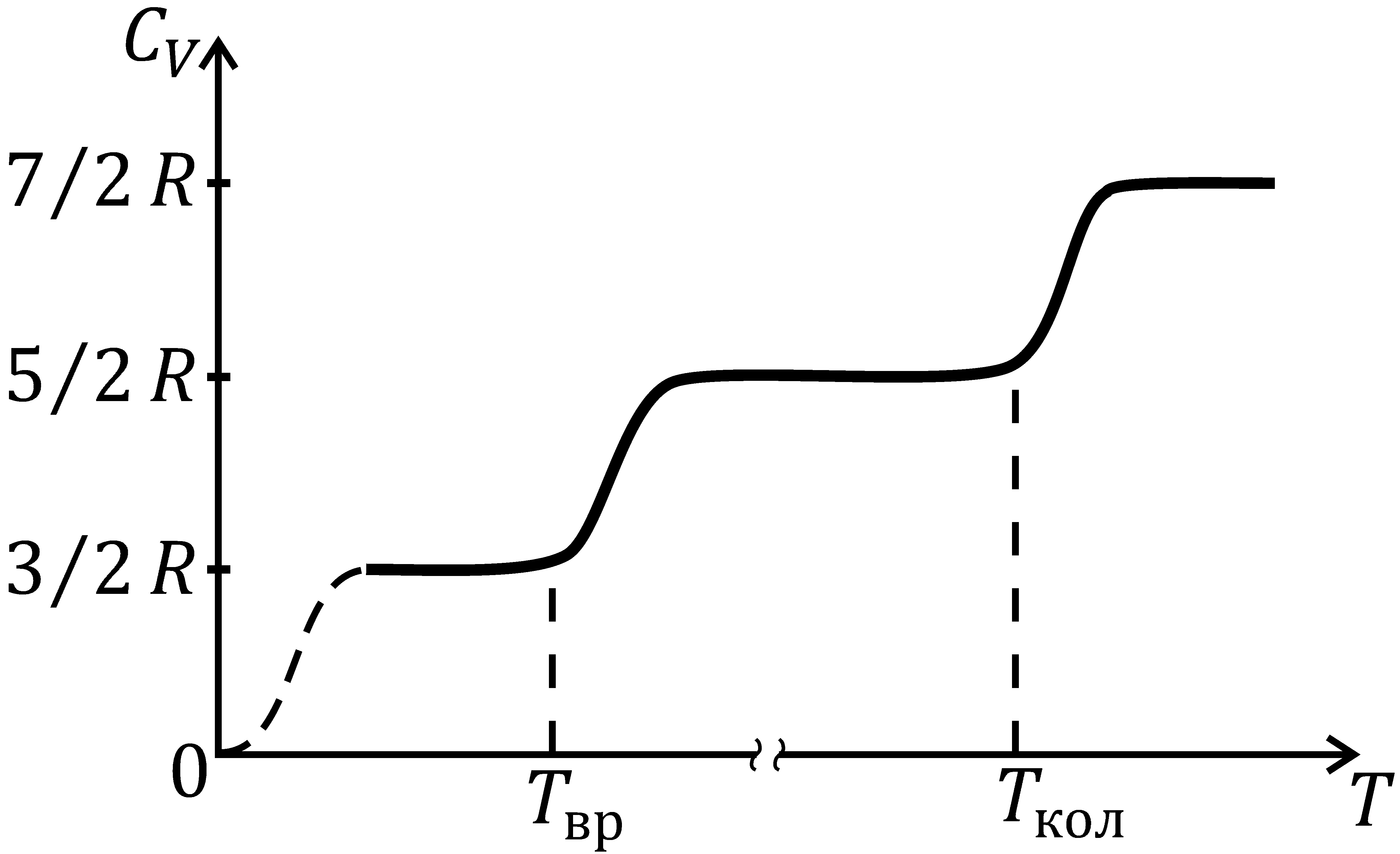 Рис. 5.4 Рис. 5.4 |
боды T вр. После чего теплоемкость быстро возрастает до значения
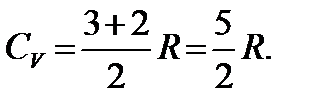
Затем она снова остается постоянной, пока температура газа не достигнет значения температуры возбуждения колебательных степеней свободы T кол. После чего теплоемкость быстро возрастает до предельного значения
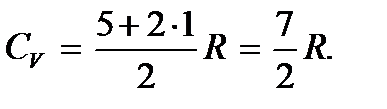
Постепенное, а не скачкообразное, увеличение теплоемкости при достижении температуры, равной соответствующей температуре возбуждения, объясняется постепенным (хотя и быстрым) увеличением числа возбужденных молекул газа.
Таким образом, только в пределах отдельных температурных интервалов теплоемкость газа не зависит от температуры, а в промежутках между ними она монотонно возрастает.
 2015-09-06
2015-09-06 1563
1563
