Опыт показывает, что в общем случае при термодинамическом взаимодействии внутренняя энергия системы будет изменяться как за счет совершения работы над системой, так и за счет теплоты, получаемой системой. Тогда при бесконечно малом изменении состояния будем иметь
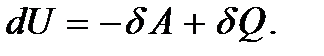 (5.8)
(5.8)
Это равенство выражает собой первое начало термодинамики в дифференциальной форме. Как уже было сказано, этот закон формулируется на основе обобщения опытных фактов. Однако к равенству (5.8) можно прийти и непосредственно из квантового статистического определения внутренней энергии, т.е. из равенства (5.1). Продифференцировав это равенство по переменным 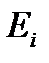 и
и 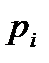 , получим
, получим
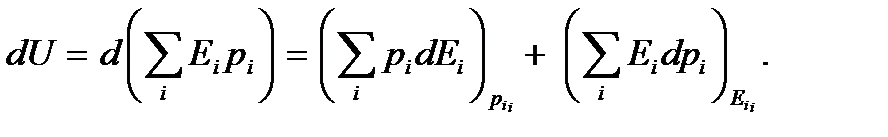
Индексы у скобок здесь обозначают те переменные, которые считаются постоянными при взятии частной производной по другой переменной. Как видим, элементарное приращение внутренней энергии естественным образом представилось в виде двух слагаемых. Первое слагаемое, очевидно, представляет собой элементарную работу, совершаемую над системой, 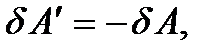 а второе – элементарную теплоту
а второе – элементарную теплоту 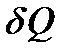 , полученную системой. Тем самым мы приходим к равенству (5.8). Проведенные рассуждения следует рассматривать ни как вывод первого закона термодинамики (он, как отмечалось выше, формулируется на основе обобщения опытных фактов), а как статистическое обоснование этого закона. С точки зрения квантовой статистической физики изменение внутренней энергии происходит за счет двух факторов - изменения уровней энергии системы и изменения распределения вероятностей состояний системы.
, полученную системой. Тем самым мы приходим к равенству (5.8). Проведенные рассуждения следует рассматривать ни как вывод первого закона термодинамики (он, как отмечалось выше, формулируется на основе обобщения опытных фактов), а как статистическое обоснование этого закона. С точки зрения квантовой статистической физики изменение внутренней энергии происходит за счет двух факторов - изменения уровней энергии системы и изменения распределения вероятностей состояний системы.
Если работа совершается самой системой, то в равенстве (5.8) элементарная работа 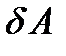 должна стоять со знаком плюс. В интегральной форме (при конечном изменении состояния) первый закон термодинамики имеет вид
должна стоять со знаком плюс. В интегральной форме (при конечном изменении состояния) первый закон термодинамики имеет вид
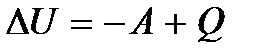 (5.9)
(5.9)
Соотношение (5.9) можно привести к виду
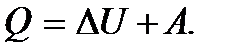 (5.10)
(5.10)
Соотношение (5.10) означает, что теплота, полученная системой, идет на увеличение ее внутренней энергии системы и на совершение системой работы против внешних сил.
Выразив 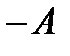 из (5.10), получим еще одну формулу первого закона термодинамики:
из (5.10), получим еще одну формулу первого закона термодинамики:
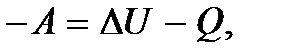 (5.11)
(5.11)
из которой следует, что в результате выполнения над системой работы увеличивается ее внутренняя энергия и выделяется вовне теплота.
Первое начало термодинамики можно записать также и в виде
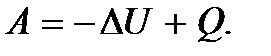 (5.12)
(5.12)
Это равенство показывает, что система может совершить работу только за счет расходования своей внутренней энергии и подвода к ней теплоты. И если 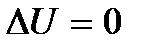 и
и 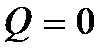 , то и
, то и 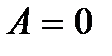 . Если учесть также, что механическая работа
. Если учесть также, что механическая работа 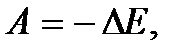 где E – полная механическая энергия, и
где E – полная механическая энергия, и 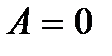 при
при 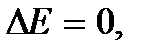 то можно сформулировать общее утверждение: не возможно произвести работу, не расходуя никакой энергии и не получая извне теплоты. Поэтому первый закон термодинамики можно сформулировать в виде утверждения о невозможности вечного двигателя первого рода – устройства, которое совершало бы работу не расходуя никакой энергии и не получая извне тепла.
то можно сформулировать общее утверждение: не возможно произвести работу, не расходуя никакой энергии и не получая извне теплоты. Поэтому первый закон термодинамики можно сформулировать в виде утверждения о невозможности вечного двигателя первого рода – устройства, которое совершало бы работу не расходуя никакой энергии и не получая извне тепла.
Уравнение (5.11) и эквивалентные ему уравнения (5.8) – (5.10) представляют собой закон сохранения и превращения энергии в общей форме. Действительно, выражение (5.8) определяет полное изменение энергии, которое может происходить как за счет тепловых воздействий, когда внешние параметры системы фиксированы, так и за счет работы, когда внешние параметры изменяются под действием так называемых обобщенных сил, которые могут иметь самую различную природу (силы механические, электрические и др.). Кроме того, из этого уравнения следует, что теплота и работа не только могут превращаться во внутреннюю энергию системы, но и друг в друга.
 2015-09-06
2015-09-06 2234
2234
