Опыт показывает, что термодинамическая система может получать и отдавать энергию и без изменения внешних параметров, т.е. без совершения работы. Такой способ передачи энергии от одной системы к другой называется теплообменом или теплопередачей. Количество энергии, переданное системе (или отданное системой) в результате теплообмена, называется количеством теплоты (или просто теплотой). Теплообмен происходит между телами, имеющими разную температуру. При теплообмене на границе между телами происходит взаимодействие медленно движущихся молекул менее нагретого тела (тела, имеющего более низкую температуру) с быстро движущимися молекулами более нагретого тела. В результате средние кинетические энергии молекул выравниваются и скорости молекул холодного тела увеличиваются, а горячего уменьшаются. Теплота, таким образом, переходит от тела с большей температурой к телу с меньшей температурой. Если 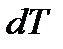 – бесконечно малое изменение температуры тела, то элементарное количество теплоты
– бесконечно малое изменение температуры тела, то элементарное количество теплоты 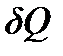 , полученное или отданное телом, можно выразить соотношением
, полученное или отданное телом, можно выразить соотношением
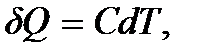 (5.7)
(5.7)
где C – физическая величина, называемая теплоемкостью тела. Теплота положительна (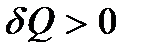 ), если тело получает ее от других тел. В этом случае температура тела повышается (
), если тело получает ее от других тел. В этом случае температура тела повышается (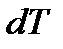 > 0). Если тело отдает теплоту, то
> 0). Если тело отдает теплоту, то 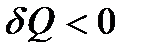 , а значит,
, а значит, 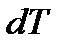 < 0 – температура тела понижается. При конечном изменении температуры от T 1 до T 2 количество теплоты, полученное или отданное телом, определится как
< 0 – температура тела понижается. При конечном изменении температуры от T 1 до T 2 количество теплоты, полученное или отданное телом, определится как
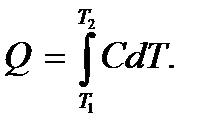
Если C = const, то Q = C (T 2 – T 1). Однако эти соотношения справедливы не всегда. Система может отдавать и получать теплоту и без изменения температуры (в изотермическом процессе, когда dT = 0). Общее выражение для элементарного количества теплоты 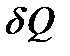 будет получено ниже.
будет получено ниже.
Как и работа, теплота не является функцией состояния, а характеризует процесс (нагревания или охлаждения тела) и, значит, зависит от вида процесса. Поэтому для ее вычисления недостаточно знать только начальное и конечное состояния, но еще и все промежуточные состояния процесса. Математически это значит, что элементарные работа δA и теплота 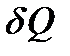 не являются полными дифференциалами какой-либо функции от параметров состояния системы. Они зависят от пути перехода из одного состояния в другое.
не являются полными дифференциалами какой-либо функции от параметров состояния системы. Они зависят от пути перехода из одного состояния в другое.
Если два тела с разными температурами привести в контакт, то энергия каждого тела вследствие теплообмена будет изменяться, но полная энергия системы будет оставаться постоянной: U 1 + + U 2 = const. Откуда
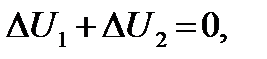
где 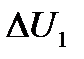 – изменение энергии первого тела,
– изменение энергии первого тела, 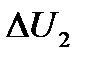 – изменение энергии второго тела. Но так как по определению
– изменение энергии второго тела. Но так как по определению 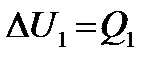 – теплота, отданная или полученная первым телом, а
– теплота, отданная или полученная первым телом, а 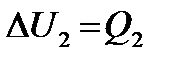 – теплота, полученная или отданная вторым телом, то получим
– теплота, полученная или отданная вторым телом, то получим
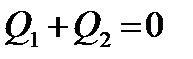 ,
,
или
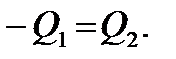
Эти соотношения выражают собой закон сохранения энергии и представляют собой уравнения теплового баланса: количество теплоты, отданное первым телом, равно количеству теплоты, полученному вторым телом.
Из выражения (5.1) следует, что при неизменных положениях уровней энергии 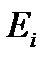 изменение внутренней энергии может быть связано только с изменением распределения вероятности
изменение внутренней энергии может быть связано только с изменением распределения вероятности 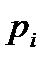 состояний, т.е. с переходом системы из одного состояния в другое. Состояния с большей энергией становятся более вероятными (при получении теплоты системой), чем состояния с меньшей энергией. В этом и заключается механизм нагревания тела.
состояний, т.е. с переходом системы из одного состояния в другое. Состояния с большей энергией становятся более вероятными (при получении теплоты системой), чем состояния с меньшей энергией. В этом и заключается механизм нагревания тела.
С молекулярной точки зрения теплота как форма передачи внутренней энергии одного тела к другому связана с хаотическими столкновениями молекул соприкасающихся тел. При соударениях молекулы более нагретого тела передают часть энергии молекулам менее нагретого тела. В результате чего внутренняя энергия одного тела будет уменьшаться, а другого возрастать. Это будет происходить до тех пор, пока средние энергии частиц, а значит, и температуры тел не станут одинаковыми. На примере
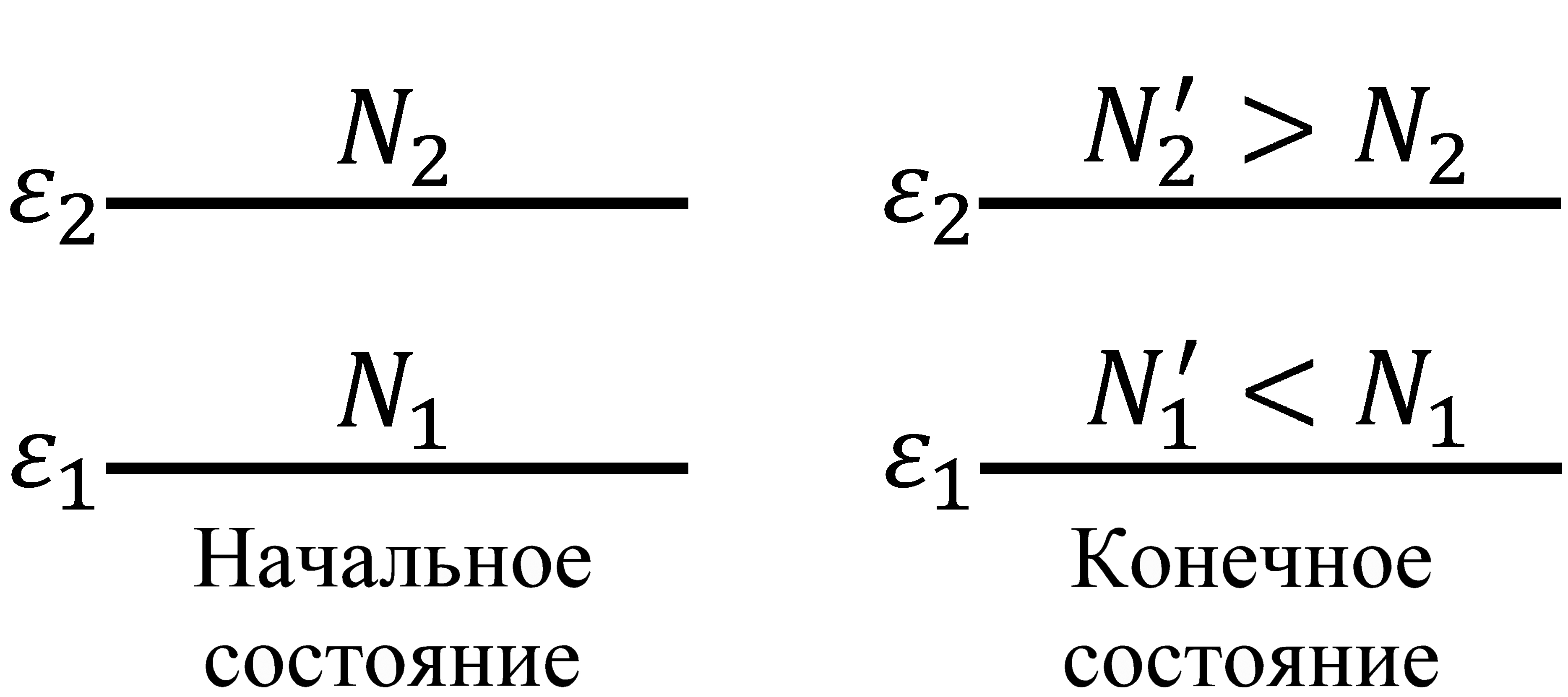 Рис. 5.3 Рис. 5.3 |
системы, состоящей из не взаимодействующих частиц (идеального газа), мы видели, что при получении газом тепла, т.е. при увеличении его температуры, происходит перераспределение молекул по кинетическим энергиям таким образом, что число молекул с малым значением энергии уменьшается, а число молекул с большим значением – возрастает. А поскольку внутренняя энергия равна среднему значению полной энергии составляющих систему частиц, то такое перераспределение и приводит к увеличению внутренней энергии газа. Следовательно, при теплопередаче внутренняя энергия возрастает не за счет увеличения энергии каждой частицы (как это происходит при совершении работы), а за счет перераспределения частиц по энергиям, при котором число частиц в системе с малым значением энергии сокращается, а число частиц с большим значением энергии возрастает. В квантовом случае на примере двухуровневой системы механизм передачи теплоты показан на рис. 5.3. Других способов изменения внутренней энергии, кроме изменения энергии каждой частицы и распределения частиц по энергиям, нет. Поэтому и существуют две формы передачи внутренней энергии.
 2015-09-06
2015-09-06 1760
1760
