| Кислота | Анион (кислотный остаток) | ||
| Формула | Название | Формула | Название |
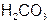 | Угольная | 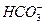 | Гидрокарбонат |
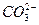 | Карбонат | ||
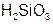 | Кремниевая | 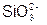 | Силикат |
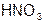 | Азотная | 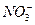 | Нитрат |
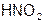 | Азотистая | 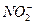 | Нитрит |
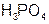 | Ортофосфорная (фосфорная) | 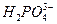 | дигидрофосфат |
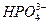 | гидрофосфат | ||
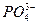 | (Орто)фосфат | ||
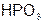 | Метафосфорная | 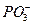 | Метафосфат |
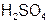 | Серная | 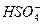 | Гидросульфат |
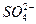 | Сульфат | ||
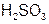 | Сернистая | 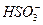 | Гидросульфит |
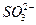 | Сульфит | ||
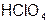 | Хлорная | 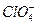 | Перхлорат |
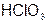 | Хлорноватая | 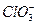 | Хлорат |
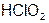 | Хлористая | 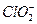 | Хлорит- |
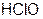 | Хлорноватистая | 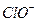 | Гипохлорит |
● Основания
Согласно международной номенклатуре названия оснований составляются из слова гидроксид и названия металла. Например, 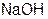 – гидроксид натрия,
– гидроксид натрия, 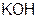 – гидроксид калия,
– гидроксид калия, 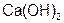 – гидроксид кальция.
– гидроксид кальция.
Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках: 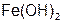 – гидроксид железа (II),
– гидроксид железа (II), 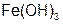 – гидроксид железа (III).
– гидроксид железа (III).
Помимо этих названий для некоторых наиболее важных оснований применяются и другие. Например, гидроксид натрия 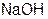 называют едкий натр; гидроксид калия
называют едкий натр; гидроксид калия 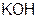 – едкое кали; гидроксид кальция
– едкое кали; гидроксид кальция 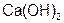 – гашеная известь; гидроксид бария
– гашеная известь; гидроксид бария 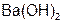 – едкий барий.
– едкий барий.
● Средние соли кислородсодержащих кислот
Названия средних солей состоят из традиционных названий катионов и анионов. Если элемент в образуемых им оксоанионах проявляет одну степень окисления, то название аниона оканчивается на -ат:
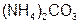 – карбон ат аммония;
– карбон ат аммония; 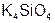 – ортосилик ат калия;
– ортосилик ат калия;
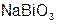 – висмут ат натрия;
– висмут ат натрия; 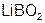 – метабор ат лития.
– метабор ат лития.
В случае двух степеней окисления ещё используют окончание -ит:
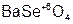 – селенат бария;
– селенат бария; 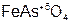 – ортоарсенат железа (III);
– ортоарсенат железа (III);
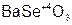 – селен ит бария;
– селен ит бария; 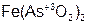 – метаарсен ит железа (II).
– метаарсен ит железа (II).
Если степеней окисления элемента в анионах может быть более двух, то для самой низкой (обычно +1) применяют приставку гипо- с окончанием -ит:
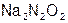 – гипо нитр ит натрия;
– гипо нитр ит натрия; 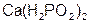 – гипо фосф ит кальция.
– гипо фосф ит кальция.
Последнее вещество является средней солью, поскольку в этом анионе два атома водорода присоединены непосредственно к атому фосфора и не проявляют кислых свойств.
Названия анионов, образованных элементом в степени окисления +7, имеют приставку пер- и окончание -ат:
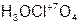 – пер хлор ат оксония;
– пер хлор ат оксония; 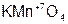 – пер манган ат калия.
– пер манган ат калия.
● Кислые и основные соли
Если в состав соли входят атомы водорода, которые при диссоциации проявляют кислотные свойства и могут быть замещены на катионы металлов, то такие соли называются кислыми. Названия таких солей образуют, добавляя к названию аниона соответствующей средней соли приставку гидро-, по необходимости добавляя числовую приставку:
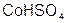 – гидро сульфат кобальта (II);
– гидро сульфат кобальта (II);
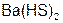 – гидро сульфид бария;
– гидро сульфид бария;
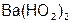 – гидро пероксид бария;
– гидро пероксид бария;
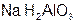 – ди гидро алюминат натрия.
– ди гидро алюминат натрия.
В случаях, когда соль, помимо кислотного остатка содержит гидроксид-ионы, такие соли называются основными. Их названия получают к названию аниона добавляют -гидроксо, также с числовой приставкой по необходимости:
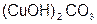 –карбонат гидроксо меди;
–карбонат гидроксо меди;
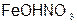 – нитрат гидроксо железа(II);
– нитрат гидроксо железа(II);
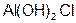 – хлоридди гидроксо алюминия.
– хлоридди гидроксо алюминия.
● Комплексные соли
В названиях таких солей используется принцип алфавитного перечисления лигандов (с окончанием -о), название элемента- комплексообразователя (в анионной форме с суффиксом -ат) и указанием заряда иона в скобках.
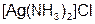 – хлорид диамминосеребра (I);
– хлорид диамминосеребра (I);
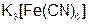 – гексацианоферрат (III) калия.
– гексацианоферрат (III) калия.
1.5. Примеры решения задач
Пример 1. Распределите соединения по классам и определите характер, назовите их: 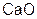 ,
, 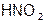 ,
, 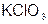 ,
, 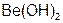 .
.
Решение: представим результаты в виде табл. 13.
Таблица 13
| Соединение | Класс | Химический характер | Название |
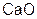 | оксид | основной | Оксид кальция |
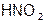 | гидроксид | кислотный | азотистая кислота |
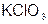 | соль | средняя (нормальная) | хлорат калия |
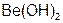 | гидроксид | амфотерный | гидроксид бериллия |
Пример 2. Докажите химический характер 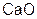 и
и 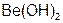 с помощью реакций.
с помощью реакций.
Решение: 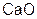 – оксид кальция, основной оксид. Реагирует с кислотой и кислотными оксидами:
– оксид кальция, основной оксид. Реагирует с кислотой и кислотными оксидами:
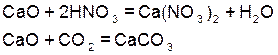
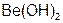 – гидроксид бериллия. Обладает как основными, так и кислотными свойствами:
– гидроксид бериллия. Обладает как основными, так и кислотными свойствами:
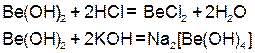
Пример 3. Осуществите превращение: напишите уравнения реакций, укажите условия протекания процесса, дайте названия соединениям:
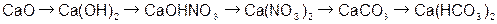 .
.
Решение:
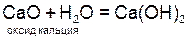 ,
,
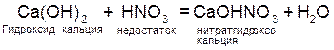 ,
,
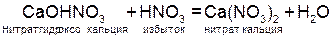 ,
,
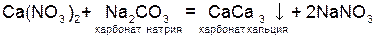 ,
,
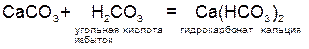 ,
,
 2015-10-22
2015-10-22 2794
2794
