1. Между мольной и массовой:

2. Между мольной и объемной:
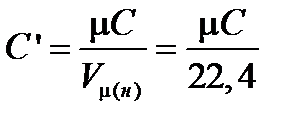
3. Между массовой и объемной:

 Vн - удельный объем газа при н.ф.у., ρн - плотность газа при н.ф.у.
Vн - удельный объем газа при н.ф.у., ρн - плотность газа при н.ф.у.
4. Между изобарной и изохорной теплоемкостями
а) Для 1 кг идеального газа справедливо уравнение Майера: Ср - Сv = R. Умножим обе части этого уравнения на µ: (получим связь между мольными теплоемкостями идеального газа)
µCp - µCv = Rμ = 8314 кДж/кмоль*К
б) Связь между объемными теплоемкостями идеального газа:

1.1 Основные понятия и определения химической термодинамики
Химическая термодинамика имеет дело с термодинамическими системами. Термодинамической системой называется тело или группа тел, находящихся во взаимодействии друг с другом и которые мысленно обособлены от окружающей среды. Различают изолированные и не изолированные системы. Система, которая не обменивается с окружающей средой теплотой и работой называется изолированной. Энергия и объём такой системы постоянны.
Если система обменивается с окружающей средой веществом и энергией, то она называется открытой. Если система обменивается с окружающей средой только энергией, то она называется закрытой. Системы, в которых это условие не соблюдается, называются неизолированными.
Различают также гомогенные и гетерогенные системы. Система называются гомогенной, если она состоит из одной фазы. Если система состоит из двух и более фаз, то она называется гетерогенной. Фазой называется гомогенная часть системы, характеризующаяся одинаковыми физико-химическими свойствами и отделенная от других частей системы поверхностью раздела.
Термодинамическая система характеризуется различными физико – химическими свойствами, которые называются термодинамическими параметрами или просто параметрами. Так идеальный газ характеризуется такими параметрами как температура Т, объём V и давление Р. Все параметры системы связаны между собой. Эту связь выражает уравнение состояния системы. Если система характеризуется такими параметрами как Т, V и P, то в общем виде уравнение состояния системы выражается уравнением
(Т,V,P) = 0 (1.1)
В качестве примера конкретного уравнения состояния может служить уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
РV = nRT, (1.2)
где n - число молей идеального газа,
R = 8,314 - универсальная газовая постоянная,  .
.
Состояние системы считается однозначно определённым, если известны все её свойства. Для определения состояния системы необязательно измерять все из них. Достаточно определить несколько свойств. Другие могут быть рассчитаны из уравнения состояния системы. Так для определения состояния идеального газа достаточно измерить два каких-либо свойства. Величина третьего свойства будет иметь строго определённое значение согласно уравнению состояния. Таким образом, для определения состояния идеального газа достаточно знать два любых свойства. Минимальное число параметров, которое необходимо знать для определения состояния системы, называются независимыми параметрами или независимыми переменными.
Свойства системы можно разбить на две группы: экстенсивные и интенсивные. Экстенсивными называются свойства, которые зависят от массы системы. Примером экстенсивного свойства может служить объём системы. Интенсивными называются свойства, которые не зависят от массы системы. Примером таких свойств идеального газа могут служить температура и давление.
В термодинамической системе протекают термодинамические процессы. Термодинамическим процессом называется всякое изменение в системе, связанное с изменением хотя бы одного параметра. Различают следующие основные термодинамические процессы, протекающие в системе:
- процесс, протекающий при постоянной температуре (Т = const), который называется изотермическим;
- процесс, протекающий при постоянном объёме (V=const)- изохорный;
- процесс, протекающий при постоянном давлении (P=const) – изобарный;
- процесс, протекающий при постоянных температуре и объёме (T = const и V = cоnst), – изохорно- изотермический;
- процесс, протекающий при постоянных температуре и давлении (Т =const и P = const), - изобарно – изотермический.
Процесс, при котором термодинамическая система, выйдя из некоторого начального состояния и претерпев ряд изменений, возвращается в то же самое состояние, называется круговым процессом или циклом. При протекании кругового процесса изменение любого параметра системы равно нулю.
Изменение некоторых свойств системы не зависит от пути протекания процесса, а зависит только от начального и конечного состояния системы. Такое свойство системы называются функцией состояния. К таким функциям можно отнести термодинамические параметры системы Т, Р и V. Любая функция состояния характеризуется полным дифференциалом.
Конечным состоянием протекания любого процесса в термодинамической системе является состояние равновесия. ^ Состоянием равновесия называется такое состояние, при котором параметры системы остаются неизменными во времени без каких-либо изменений в окружающей среде. Если параметры системы остаются постоянными во времени за счёт каких – либо изменений в окружающей среде, то такое состояние называется стационарным.
^ 1.2 Внутренняя энергия, теплота и работа.
Первый закон термодинамики
Внутренней энергией называется сумма кинетической энергии движения частей системы и потенциальной энергии их взаимодействия между собой. Абсолютную величину внутренней энергии системы ни определить, ни рассчитать невозможно. Химическая термодинамика позволяет определять и рассчитывать изменение внутренней энергии системы при переходе системы из одного состояния в другое. Все изменения внутренней энергии при переходе системы из одного состояния в другое можно разделить на две группы: изменения энергии, связанные с передачей теплоты и изменения энергии, связанные с совершением работы. Таким образом, теплота и работа являются формами перехода внутренней энергии от одного тела к другому. Они измеряются в тех же единицах, что и энергия. Взаимосвязь между внутренней энергией, теплом и работой устанавливает первый закон термодинамики, который гласит: теплота, подведённая к системе, расходуется на изменение внутренней энергии и совершение работы:
Q = ΔU + A, (1.3)
где Q – теплота, Дж
ΔU – изменение внутренней энергии, Дж
А – работа, Дж.
Изменение внутренней энергии не зависит от пути протекания процесса, а определяется лишь начальным и конечным состоянием системы. Это значит, внутренняя энергия является функцией состояния системы. Теплота и работа в общем случае не являются функциями состояния системы и их изменение зависит от пути процесса. С учётом этого математическая формулировка первого закона термодинамики будет иметь вид:
δQ = dU + δA, (1.4)
где dU – полный дифференциал внутренней энергии системы;
δQ – бесконечно малое изменение теплоты;
δА – бесконечно малое изменение работы.
В последнем уравнении знак полного дифференциала (d) характеризует функцию состояния системы U, а знак δ характеризует бесконечно малое изменение свойств системы Q и А, которые не являются функциями состояния.
Для изолированных систем справедливо, когда δQ = 0 и δA = 0, уравнения (1.3) и (1.4) примут вид:
dU = 0 или ΔU = 0 (1.5)
Из уравнения (1.5) следует, что внутренняя энергия изолированных систем постоянна:
U = Const (1.6)
Уравнение (1.6) представляет собой математическую формулировку первого закона термодинамики для изолированных систем.
Изменение внутренней энергии системы может происходить за счёт обмена теплотой и работой с окружающей средой. В химической термодинамике принято называть теплоту положительной (Q > 0), если система поглощает теплоту, и отрицательной (Q < 0), если система выделяет теплоту в окружающую среду. Работу принято считать положительной (A>0), если система совершает работу над окружающей средой, и отрицательной (A<0), если окружающая среда совершает работу над системой. Если системой является идеальный газ, то положительной работой является работа расширения, а отрицательной – работа сжатия.
Первый закон термодинамики является постулатом, выведенным из многовекового опыта человеческой деятельности. Все формулировки первого закона равноценны. Если принять одну из них за основу, то другие получаются из неё как следствия.
^ 1.3 Применение первого закона термодинамики
к идеальным газам
Если в качестве термодинамической системы выбран идеальный газ, то единственной работой в уравнении первого закона термодинамики является работа расширения (сжатия) идеального газа, которая вырaжается уравнением:
δA = PdV (1.7)
С учётом работы расширения идеального газа уравнение первого закона термодинамики можно записать в виде:
δQ = dU + PdV (1.8)
Рассмотрим применение первого закона термодинамики к различным процессам.
1.3.1 Изотермический процесс
Внутренняя энергия идеального газа не зависит от давления и объёма газа, а зависит только от температуры. Если температура системы постоянна, то и внутренняя энергия системы будет оставаться постоянной (U = const) или
dU = 0 (1.9)
Тогда уравнение первого закона термодинамики для изотермического процесса можно записать в виде:
δQ = PdV (1.10)
Интегрирование уравнения в пределах 1 – 2 состояния системы даёт:
QТ = 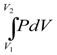 (1.11)
(1.11)
С учётом уравнения состояния идеального газа (1.2) получим:
QТ =  (1.12)
(1.12)
Откуда получим:
QT = nRTln  (1.13)
(1.13)
Для изотермического процесса справедливо соотношениe:
P1V1 = P2V2 (1.14)
Тогда для изотермического процесса можно записать:
QT = nRTln  = nRTln
= nRTln 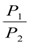 (1.15)
(1.15)
1.3.2 Изохорный процесс
Для изохорного процесса (V = const), при котором работа не совершается (δA = 0), уравнение первого закона термодинамики принимает вид:
δQV = dU (1.16)
Изменение внутренней энергии при протекании изохорного процесса определяется уравнением:
dU = nCVdT (1.17)
или в интегральной форме
QV = ΔU = nCV(T2-T1), (1.18)
где СV – теплоёмкость при постоянном давлении,  .
.
1.3.3 Изобарный процесс
Для изобарного процесса изменение внутренней энергии определится уравнением(1.18). Поскольку изобарный процесс протекает при постоянном давлении, то работа системы может быть определена по уравнению:
A = 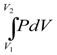 = P(V2 - V1) (1.19)
= P(V2 - V1) (1.19)
C учётом того, что PV1= nRT1 и PV2 = nRT2, уравнение (1.19) примет вид:
A = nR(Т2 - Т1) (1.20)
Теплота, сопровождающая изобарный процесс, определяется из уравнения:
QP = nCP(T2 – T1), (1.21)
где СР - теплоёмкость при постоянном давлении,  .
.
^ 1.4 Тепловой эффект химической реакции
Тепловым эффектом химической реакции называется количество теплоты, которое выделяется или поглощается в результате протекания химической реакции при условии, что химическая реакция протекает:
- при постоянном давлении или постоянном объёме;
- при протекании реакции совершается только работа расширения (P=const) или не совершается никакой работы (V= const);
- температура исходных веществ и продуктов реакции одинаковы.
Только при соблюдении этих условий теплота, выделяющаяся или поглощающаяся в результате протекания химической реакции, будет иметь строго определённое значение для данной реакции.
Рассмотрим химическую реакцию, протекающую при постоянном объёме. Уравнение первого закона термодинамики для такой реакции будет иметь вид:
QV = ΔU = U2 – U1 (1.22)
Таким образом, если химическая реакция протекает при постоянном объёме, то тепловой эффект реакции приобретает свойства функции состояния внутренней энергии.
Для химической реакции, протекающей при постоянном давлении, уравнение первого закона термодинамики имеет вид:
δQP = dU + PdV (1.23)
Интегрирование уравнения даёт:
QP = (U2 – U1) + P(V2 –V1) (1.24)
или
QP = ΔU + PΔV (1.25)
После преобразования уравнения (1.24) получим:
QP = (U2 + PV1) – (U2 + PV1) (1.26)
Выражение в скобках называется энтальпией
U + PV = H, (1.27)
где Н – энтальпия.
Поскольку в уравнении (1.25) внутренняя энергия U является функцией состояния, параметры Р и V также обладают свойствами функции состояния. Из этого следует что, энтальпия Н также является функцией состояния. Тогда тепловой эффект химической реакции, протекающей при постоянном давлении определяется изменением функции состояния – энтальпии:
QP = H2 – H1 = ΔH (1.28)
Таким образом, если химическая реакция протекает при постоянном давлении, то тепловой эффект реакции приобретает свойства функции состояния энтальпии.
Изменение энтальпии ΔН в химической термодинамике называют тепловым эффектом химической реакции, протекающей при постоянном давлении. Для экзотермических реакций, протекающих с выделением теплоты, величина ΔН < 0; для эндотермических реакций, протекающих с поглощением теплоты, величина ΔН > 0.
Для сравнения тепловых эффектов различных химических реакций в химической термодинамике используется понятие стандартного теплового эффекта химической реакции. Стандартным тепловым эффектом называется тепловой эффект химической реакции, протекающей в стандартных условиях. В этом случае все участники реакции находятся в стандартном состоянии. В качестве стандартного состояния для любого газообразного вещества принимается состояние, при котором газ является идеальным, а его давление равно 1атм. (101323 Па). Для конденсированных веществ (жидких и твёрдых) в качестве стандартного состояния принимается их естественное состояние при данной температуре под общим давлением 1атм. Стандартный тепловой эффект обозначаетсяΔНо и читается как «дельта аш стандартное».
Между тепловыми эффектами химической реакции, протекающей при постоянном давлении и постоянном объёме, существует связь, которая выражается уравнением:
QP = QV + PΔV (1.29)
Из уравнения состояния идеального газа вытекает, что PΔV = ΔnRT, тогда
QP = QV + ΔnRT, (1.30)
где Δn – изменение числа молей газообразных участников реакции.
Величина Δn равна сумме числа молей газообразных продуктов реакции минус сумму числа молей газообразных исходных веществ.
С учётом уравнений (1.22) и (1.28) уравнение (1.30) можно записать в виде:
ΔH = ΔU + ΔnRT (1.31)
^ 1.5 Закон Гесса и следствия из него
Тепловой эффект химической реакции, протекающей при постоянном объёме или при постоянном давлении характеризуется свойствами функции состояния. Изменение функции состояния не зависит от пути процесса, а определяется только конечным и начальным состоянием системы. Это положение, применённое к химическим реакциям представляет собой закон Гесса, который гласит: тепловой эффект химической реакции не зависит от пути её протекания, а определяется только начальным и конечным состоянием участников реакции и их природой. Закон Гесса можно продемонстрировать схемой превращения углерода в его диоксид

+ О2



 С(тв) СО2(газ)
С(тв) СО2(газ)

 ΔН1
ΔН1
+ 0,5O2 ΔH2 ΔН3 +0,5О2
CO
Тепловой эффект по пути 1 равен сумме тепловых эффектов по пути 2 и 3:
ΔН1 = ΔН2 + ΔН3 (1.32)
Из закона Гесса вытекает несколько следствий, которые широко используются для термохимических расчётов.
Первое следствие гласит: тепловой эффект химической реакции равен по величине и противоположен по знаку тепловому эффекту обратной химической реакции. Например, для реакции
СаСО3(тв) = СаО(тв) + СО2(газ) (1.33)
тепловой эффект при температуре 298 К равен 21,77 кДж, а для реакции
СаО(тв) + СО2(газ) = СаСО3(тв) (1.34)
он равен – 21,77 кДж.
Согласно второму следствию, тепловой эффект любой химической реакции равен сумме теплот образования продуктов реакции минус сумму теплот образования исходных веществ с учётом стехиометрических коэффициентов. Под теплотой образования понимают тепловой эффект химической реакции образования одного моля вещества из простых веществ. Теплота образования простого вещества принята равной нулю. Например, стандартный тепловой эффект химической реакции
2Fe2O3(тв) + С(тв) = 4FeO(тв) + СО2(газ) (1.35)
при температуре 298 К равен
ΔН  = 4ΔН
= 4ΔН  (FeO) + ΔН
(FeO) + ΔН  (CO2) - 2ΔН
(CO2) - 2ΔН  (Fe2O3) (1.36)
(Fe2O3) (1.36)
где ΔН  (i)- теплота образования i – го участника реакции.
(i)- теплота образования i – го участника реакции.
Тепловой эффект образования углерода, как простого вещества, равен нулю. Величины теплот образования различных соединений при температуре 298 К приведены в термодинамических таблицах.
Третье следствие гласит: тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ минус сумму теплот сгорания продуктов реакции с учётом стехиометрических коэффициентов. Под теплотой сгорания понимают тепловой эффект химической реакции сгорания одного моля вещества до высших оксидов. Например, тепловой эффект химической реакции
С(тв) + 2Н2(газ) = СН4(газ) (1.37)
при температуре 298 К равен
ΔН  = ΔН
= ΔН  (С) + 2ΔН
(С) + 2ΔН  (Н2) - ΔН
(Н2) - ΔН  (СН4) (1.38)
(СН4) (1.38)
где ΔН  (i)- теплота сгорания i – го участника реакции.
(i)- теплота сгорания i – го участника реакции.
^ 1.6 Теплоёмкость и её зависимость температуры
Теплоёмкостью называется количество тепла, которое необходимо подвести к единице массы вещества, чтобы повысить его температуру на один градус. В зависимости от единицы массы вещества различают удельную ( ) и молярную (
) и молярную ( ) теплоёмкость. В химической термодинамике для практических расчётов, как правило, используется молярная теплоёмкость. Различают среднюю и истинную теплоёмкость.
) теплоёмкость. В химической термодинамике для практических расчётов, как правило, используется молярная теплоёмкость. Различают среднюю и истинную теплоёмкость.
^ Средней молярной теплоёмкостью  в интервале температур от Т1 до Т2 называется отношение количества теплоты, подведённого к одному молю вещества, к разности температур Т2 – Т1:
в интервале температур от Т1 до Т2 называется отношение количества теплоты, подведённого к одному молю вещества, к разности температур Т2 – Т1:
 (1.39)
(1.39)
^ Истинной теплоёмкостью С называется отношение бесконечно малого количества теплоты, которое необходимо подвести к одному молю вещества, к бесконечно малому приращению температуры, которое при этом наблюдается:
С =  (1.40)
(1.40)
В зависимости от условий протекания химической реакции различают теплоёмкость при постоянном объёме СV, которая определяется уравнением:
СV =  (1.41)
(1.41)
и теплоёмкость при постоянном давлении:
СР =  (1.42)
(1.42)
В интегральной форме уравнения (1.41) и (1.42) для n молей вещества можно записать в виде:
QV =ΔU =n  (1.43)
(1.43)
и
QP = ΔH = n 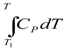 (1.44)
(1.44)
Если в интервале температур Т1 – Т2 теплоёмкость не зависит от температуры, т.е. является постоянной, то после интегрирования уравнений (1.43) и (1.44) получим:
QV =ΔU = nCV(T2 – T1) (1.45)
и
QP =ΔU = nCP(T2 – T1) (1.46)
Для твёрдых и жидких тел разность между СР и CV мала. Для идеальных газов эта разница достаточно велика и определяется соотношением
СР – СV = R (1.47)
Теплоёмкость вещества зависит от температуры. Для органических веществ эта зависимость выражается эмпирическим уравнением:
СР = а + bT + сТ2 (1.48)
Для неорганических веществ эта зависимость имеет вид:
СР = а + bT + с′ Т-2, (1.49)
где а, b, c и с′- постоянные, независящие от температуры, а зависящие
только от природы вещества.
Если в уравнение (1.39) подставить (1.44), то получим уравнение, выражающее связь между средней и истинной теплоёмкостями при постоянном давлении:
 (1.50)
(1.50)
Среднюю теплоёмкость можно рассчитать графическим путём, если известны значения истинной теплоёмкости в каком–либо интервале температур.
7.
Зависимость теплового эффекта химической реакции от температуры
Рассмотрим в общем виде химическую реакцию, протекающую при постоянном объёме:
аА + bB = mM + nN (1.51)
Изменение энтальпии для химической реакции, как функции состояния составит:
ΔН = nHN + mHM – aHA - bHB, (1.52)
где – Hi – энтальпия одного моля i - го участника реакции.
ΔH – тепловой эффект химической реакции, протекающей при
постоянном давлении.
Продифференцируем уравнение (1.52) по температуре:
 n
n  + m
+ m  - a
- a  - b
- b  (1.53)
(1.53)
Отношение  представляет собой теплоёмкость при постоянном давлении i- го участника реакции СP
представляет собой теплоёмкость при постоянном давлении i- го участника реакции СP  . С учётом этого можно записать:
. С учётом этого можно записать:
 nC
nC  + mC
+ mC 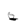 - aC
- aC  - bC
- bC  (1.54)
(1.54)
Обозначим
nC  + mC
+ mC 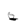 - aC
- aC  - bC
- bC  = ΔСР (1.55)
= ΔСР (1.55)
где ΔСР – изменение теплоёмкости химической реакции.
Изменение теплоёмкости химической реакции равно сумме теплоёмкостей продуктов реакции минус сумму теплоёмкостей исходных веществ с учётом стехиометрических коэффициентов. Для любой химической реакции можно записать:
ΔСР =  , (1.56)
, (1.56)
где  - стехиометрический коэффициент i - го участника реакции;
- стехиометрический коэффициент i - го участника реакции;
СР  - теплоёмкость i - го участника реакции,
- теплоёмкость i - го участника реакции,  .
.
Таким образом, можно записать
 = ΔСР (1.57)
= ΔСР (1.57)
или
 dΔH = ΔCPdT (1.58)
dΔH = ΔCPdT (1.58)
Уравнения (1.58) и (1.59) выражают зависимость теплового эффекта химической реакции, протекающей при постоянном давлении, от температуры. Рассуждая аналогичным способом можно получить такую же зависимость для химической реакции, протекающей при постоянном объёме:
 или
или 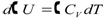 (1.59)
(1.59)
Неопределённое интегрирование уравнения (1.59) для химической реакции, протекающей в стандартных условиях, даёт:
ΔН  = ΔН0 +
= ΔН0 +  , (1.60)
, (1.60)
где ΔН0 – постоянная интегрирования.
С учётом зависимости теплоёмкостей участников реакции от температуры для реакции (1.51) можно записать:
ΔСР = m∙  +m∙bMT + m∙c
+m∙bMT + m∙c  T-2 +
T-2 +
n∙  + n∙bNT + n∙c
+ n∙bNT + n∙c  T-2
T-2
- a∙  - a∙bAT - a∙c
- a∙bAT - a∙c  T-2
T-2
- b∙ 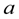 B - b∙bBT - b∙c
B - b∙bBT - b∙c  T-2 =
T-2 =
Δ 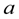 + ΔbT + Δc
+ ΔbT + Δc  T-2 (1.61)
T-2 (1.61)
После подстановки (1.62) в (1.61) получим:
ΔН  = ΔН0 +
= ΔН0 +  (1.62)
(1.62)
После интегрирования получим:
ΔН  = ΔН0 +
= ΔН0 +  (1.63)
(1.63)
Определённое интегрирование уравнения (1.59) в пределах интервала температур от 298 К до Т даёт:
ΔН  = ΔН
= ΔН  +
+  (1.64)
(1.64)
или
ΔН  = ΔН
= ΔН  +
+  (Т – 298) +
(Т – 298) +  Δb(T2 -2982) – Δc’(T-1 – 298-1) (1.66)
Δb(T2 -2982) – Δc’(T-1 – 298-1) (1.66)
Таким образом, для того, чтобы рассчитать зависимость теплового эффекта химической реакции от температуры необходимо знать:
1) зависимость теплоёмкостей участников реакции от температуры для расчета величин Δ 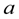 , Δb и Δс′;
, Δb и Δс′;
2) значение теплового эффекта химической реакции при какой – либо температуре для расчёта постоянной интегрирования ΔН0.
Теплоемкостьсистемы(или тела) - ϶ᴛᴏ отношение количества сообщенной системе теплоты к наблюдаемому при этом повышению температуры (при отсутствии химической реакции, переходов вещества из одного агрегатного состояния в другое).
Теплоемкость пропорциональна количеству вещества. Различают удельную и молярную теплоемкость.
Удельная теплоемкость Суд - ϶ᴛᴏколичествотеплоты, крайне важное для нагревания единицы массы вещества на 1 К. Единица измерения удельной теплоемкости – Дж/(г×К).
Молярная теплоемкость С - ϶ᴛᴏколичествотеплоты, крайневажноедлянагревания 1 мольвеществана 1 К. Единицаизмерениямолярнойтеплоемкости – Дж/(моль×К).
Молярная и удельная теплоемкости связаны соотношением:
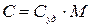 ,
,
где М – молярная масса.
Различают среднюю и истинную теплоемкости.
Средняя теплоемкость  определяется отношением сообщенной системе теплоты к наблюдаемому при этом повышению температуры:
определяется отношением сообщенной системе теплоты к наблюдаемому при этом повышению температуры:
 . (1.7)
. (1.7)
Истинная теплоемкость С соответствует бесконечно малому изменению температуры:
 . (1.8)
. (1.8)
Легко установить связь между средней и истинной теплоемкостями, интегрируя (1.8) в интервале температур от Т 1 до Т 2 и подставляя полученное выражение для Q в (1.7):

Учитывая зависимость отусловий, при которых производится нагревание, различают теплоемкость при постоянном объеме СV (изохорную теплоемкость) и теплоемкость при постоянном давлении Cp (изобарную теплоемкость):
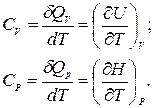 (1.9)
(1.9)
В случае если нагревание осуществляется при V = const, вся теплота идет на увеличение внутренней энергии; при p = const кроме увеличения внутренней энергии совершается работа расширения.
В случае если постоянство объема или давления оговаривается, частную производную в (1.9) заменяют полной:
 (1.10)
(1.10)
Интегрируя выражения (1.10) в интервале температур от Т 1 до Т 2, и принимая, что Cp и СV в указанном интервале температур постоянны, получим:

Установим взаимосвязь между Cp и СV для 1 моль идеального газа. В соответствии с уравнением Менделœеева-Клапейрона (1.1)
pV = RT.
Тогда

Таким образом,
 .
.
Изобарная и изохорная теплоемкости идеального газа отличаются на величину универсальной газовой постоянной R.
Для одноатомного идеального газа
 .
.
Для двухатомного идеального газа при средних температурах

Изобарная и изохорная теплоемкости твердых веществ практически равны.
Теплоемкость твердых, жидких и газообразных тел зависит от температуры. Наиболее часто зависимость теплоемкости индивидуальных веществ от температуры выражается эмпирическим уравнением вида:
 , (1.11)
, (1.11)
где a, b, c, c ’ – эмпирические коэффициенты, вычисленные на основе экспериментальных данных.
Для органических веществ коэффициент c ’ = 0, для неорганических – c = 0.
Данное эмпирическое уравнение применимо только в определœенноминтервалетемператур. Поэтойпричинекоэффициенты a, b, c и c’ не имеют физического смысла. Для многих веществ они приведены в справочниках (с указанием температурного интервала, в котором их можно использовать).
1.3.3 Влияние температуры на тепловой эффект
химической реакции. Уравнение Кирхгофа
Температура оказывает большое влияние на тепловые эффекты химических реакций. Поставим задачу количественно охарактеризовать это влияние.
Рассмотрим химическую реакцию, протекающую при р = const:
 .
.
Пусть энтальпия исходных веществ, участвующих в реакции равна Н 1, а энтальпия продуктов реакции – Н 2. Тогда
 , (1.12)
, (1.12)
где 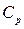 – теплоемкость системы в исходном состоянии:
– теплоемкость системы в исходном состоянии:
 .
.
Аналогично, для продуктов реакции:
 , (1.13)
, (1.13)
 .
.
Вычитая почленно из уравнения (1.13) уравнение (1.12), получим:
 ,
,
где  .
.
Для химической реакции  равно
равно
 .
.
Аналогично для процессов, протекающих при V = const,
 ,
,
 ,
,
 . (1.14)
. (1.14)
Для химической реакции
 .
.
Полученные уравнения (1.13), (1.14) выражают закон Кирхгофа:
Температурный коэффициент теплого эффекта химической реакции (или других процессов), протекающих при р = const или V = const равен разности теплоемкостей системы в исходном и конечном состоянии.
Проанализируем уравнения Кирхгофа.
Из уравнений следует, что влияние температуры на тепловой эффект обусловливается знаком величины  :
:
– если Δ Ср > 0, то производная  , следовательно, с повышением температуры тепловой эффект реакции будет возрастать;
, следовательно, с повышением температуры тепловой эффект реакции будет возрастать;
– если Δ Ср < 0, то производная  , следовательно, с повышением температуры тепловой эффект реакции уменьшается;
, следовательно, с повышением температуры тепловой эффект реакции уменьшается;
– если Δ Ср = 0, то тепловой эффект реакции не зависит от температуры.
Закон Кирхгофа позволяет рассчитывать тепловые эффекты реакции при любой температуре.
Получим уравнение для расчета теплового эффекта͵протекающегопри р = const. Разделим переменные в уравнении Кирхгофа:
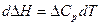 .
.
При интегрировании уравнения Кирхгофа часто используется температурная зависимость теплоемкости в виде степенных рядов, которые справедливы в определœенномтемпературноминтервале. Чащевсœегоинтегрированиепроводятвопределœенныхпределах, принявзанижний предел интегрирования температуру 298 К, а за верхний – температуру Т. Тепловой эффект реакции при 298 К можно легко рассчитать, используя первое или второе следствия из закона Гесса. В результате интегрирования получим:
 . (1.15)
. (1.15)
Так как изобарная теплоемкость обладает свойствами функции состояния, для Δ Ср можно записать:
 ,
,
где
 ,
,
 ,
,
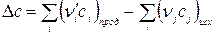 ,
,
 .
.
Подставив выражение для Δ Ср в (1.15) и проинтегрировав, получим:
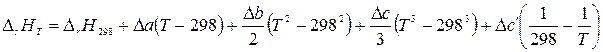 .
.
В случае если в интервале температур от 298 К до Т одно из реагирующих веществ претерпевает изменение агрегатного состояния, то есть происходит фазовое превращение, то интервал температур разбивается на два интервала: от 298 К до Т ф.п. (температура, при которой происходит фазовый переход) и от Т ф.п. до Т:
 .
.
Вычисление теплового эффекта по уравнению Кирхгофа значительно упрощается, если воспользоваться средними теплоемкостями  для реагентов или принять, что
для реагентов или принять, что  не зависит от температуры в данном интервале.
не зависит от температуры в данном интервале.
Тогда
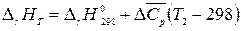 , (1.16)
, (1.16)
где  .
.
Приведем уравнение (1.16) к виду
 .
.
Выражение, заключенное в скобки, всœегдапостоянно, такимобразом, вданномслучаезависимостьтепловогоэффектаоттемпературыявляетсялинœейной. Недостатокданногометодарасчетатепловыхэффектовзаключаетсявегоневысокойточности.
Теплоемкость – теплофизическая характеристика, которая определяет способность тел отдавать или воспринимать теплоту, чтобы изменять температуру тела. Отношение количества теплоты, подведенной (или отведенной) в данном процессе, к изменению температуры называется теплоемкостью тела (системы тел):C=dQ/dT, где 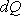 — элементарное количество теплоты;
— элементарное количество теплоты;  — элементарное изменение температуры.
— элементарное изменение температуры.
Теплоемкость численно равна количеству теплоты, которое необходимо подвести к системе, чтобы при заданных условиях повысить ее температуру на 1 градус. Единицей теплоемкости будет Дж/К.
В зависимости от количественной единицы тела, к которому подводится теплота в термодинамике, различают массовую, объемную и мольную теплоемкости.
Массовая теплоемкость — это теплоемкость, отнесенная к единице массы рабочего тела,c=C/m
Единицей измерения массовой теплоемкости является Дж/(кг×К). Массовую теплоемкость называют также удельной теплоемкостью.
Объемная теплоемкость — теплоемкость, отнесенная к единице объема рабочего тела, где и — объем и плотность тела при нормальных физических условиях. C’=c/V=cp. Объемная теплоемкость измеряется в Дж/(м3×К).
Мольная теплоемкость — теплоемкость, отнесенная к количеству рабочего тела (газа) в молях,Cm=C/n, где n — количество газа в молях.
Мольную теплоемкость измеряют в Дж/(моль×К).
Массовая и мольная теплоемкости связаны следующим соотношением: 
Объемная теплоемкость газов выражается через мольную как 
Где  м3/моль — мольный объем газа при нормальных условиях.
м3/моль — мольный объем газа при нормальных условиях.
Уравнение Майера: Ср – Сv = R.
Учитывая, что теплоемкость непостоянна, а зависит от температуры и других термических параметров, различают истинную и среднюю теплоемкости. В частности, если хотят подчеркнуть зависимость теплоёмкости рабочего тела от температуры, то записывают её как C(t), а удельную – как c(t). Обычно под истинной теплоёмкостью понимают отношение элементарного количества теплоты, которое сообщается термодинамической системе в каком-либо процессе к бесконечно малому приращению температуры этой системы, вызванному сообщенной теплотой. Будем считать C(t) истинной теплоёмкостью термодинамической системы при температуре системы равной t1, а c(t) - истинной удельной теплоёмкостью рабочего тела при его температуре равной t2. Тогда среднюю удельную теплоёмкость рабочего тела при изменении его температуры от t1 до t2 можно определить как

Обычно в таблицах приводятся средние значения теплоемкости cср для различных интервалов температур, начинающихся с t1=00C. Поэтому во всех случаях, когда термодинамический процесс проходит в интервале температур от t1 до t2, в котором t1≠0, количество удельной теплоты q процесса определяется с использованием табличных значений средних теплоемкостей cср следующим образом:

Значения средних теплоемкостей  и
и  , находят по таблицам.
, находят по таблицам.
 2017-12-14
2017-12-14 12613
12613







