Внутренняя энергия системы может изменяться в результате теплообмена. Т.е., если к системе подводится теплота в количестве dQ, а работа не производится dW = 0, то согласно I закона термодинамики
dU = dQ – dW = dQ
dU = dQ (6.32)
Теплота - способ изменения внутренней энергии системы без изменения внешних параметров (dV = 0 ® dW = 0), это микроскопический способ преобразования энергии.
При поглощении системой некоторого количества теплоты dQ внутренняя энергия ее увеличивается на величину dU (согласно формуле (6.32.)). Возрастание внутренней энергии ведет к увеличению интенсив-ности движения частиц, составляющих систему. Согласно выводам статистической физики средняя скорость движения молекул связана с температурой
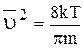
Т.е. поглощение системой некоторого количества теплоты dQ ведет к увеличению температуры системы на величину dT, пропорциональную dQ.
dT = const.dQ (6.33)
Соотношение (6.33) можно переписать в другом виде:
dQ = C.dT или 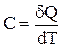 , (6.34)
, (6.34)
где С – константа, называемая теплоемкостью системы.
Итак, теплоемкость – это количество теплоты, необходимое для нагревания термодинамической системы на один градус по шкале Кельвина.
Теплоемкость системы зависит от:
а) состава и температуры системы;
б) размера системы;
в) условий, при которых происходит переход теплоты.
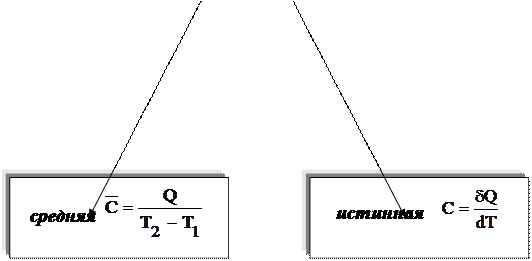 |

Схема 6.6. Виды теплоемкости
Т.е. С (теплоемкость), как и Q, является функцией процесса, а не состояния и относится к экстенсивным параметрам.
По количеству нагреваемого вещества различают:
1) удельную теплоемкость Суд, отнесенную к 1 кг или 1 г вещества;
2) молярную (мольную) теплоемкость См, отнесенную к 1 моль вещества.
Размерность {Суд} = Дж/г .К
{См} = Дж/моль . К
Между удельной и молярной теплоемкостями имеется соотношение
См = Суд . М, (6.35)
где М – молярная масса.
При описании физико-химических процессов обычно пользуются молярной теплоемкостью См (в дальнейшем индекс писать не будем).
Различают также среднюю и истинную теплоемкости.
Средняя теплоемкость 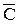 – это отношение некоторого количества теплоты к разности температур
– это отношение некоторого количества теплоты к разности температур
(6.36)
Истинной теплоемкостью С называют отношение бесконечно малого количества теплотыdQ, которое нужно подвести к одному моль вещества, к бесконечно малому приращению температуры – dT.
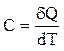
Установим связь между истинной и средней теплоемкостями.
Во-первых, 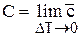
Во-вторых, выразим Q из формулы (6.36) 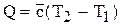 (6.37). С другой стороны из формулы (6.34) ® dQ = CdT (6.38). Проинтегрируем (6.38) в интервале T1 - T2 и получим
(6.37). С другой стороны из формулы (6.34) ® dQ = CdT (6.38). Проинтегрируем (6.38) в интервале T1 - T2 и получим
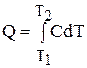 (6.39)
(6.39)
Приравняем правые части выражений (6.37) и (6.39)
Отсюда 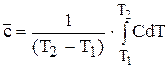 (6.40)
(6.40)
Это уравнение связывает среднюю теплоемкость 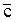 с истинной С.
с истинной С.
Среднюю теплоемкость рассчитывают в интервале температур от Т1 до Т2. Нередко интервал выбирают от ОК до Т, т.е. нижний предел Т1 = ОК, а верхний имеет переменное значение, т.е. от определенного интервала перейдем к неопределенному. Тогда уравнение (6.40) примет вид:
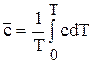 (6.41)
(6.41)
Расчет 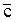 можно провести графически, если известны значения истинной теплоемкости при нескольких температурах. Зависимость С = f(T) представлена кривой АВ на рис. 1.
можно провести графически, если известны значения истинной теплоемкости при нескольких температурах. Зависимость С = f(T) представлена кривой АВ на рис. 1.
 |
Рис. 6.7. Графическое определение средней теплоемкости
Интеграл в выражении (6.40) представляет собой площадь фигуры Т1АВТ2.
Таким образом, измерив площадь, определяем
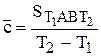 (6.42)
(6.42)
Рассмотрим значение теплоемкости системы при некоторых условиях:
а) V = сonst
Согласно I закону термодинамики dQV = dU. Для простых систем внутренняя энергия является функцией объема и температуры U = U (V,T)
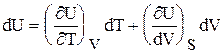
Теплоемкость в этих условиях
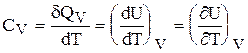 (6.43)
(6.43)
б) p = const
dQp = dH. Для простых систем H = H(p,T);
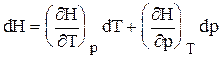
Теплоемкость
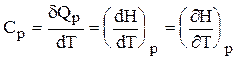 (6.44)
(6.44)
Ср и СV - теплоемкости при постоянных p и V.
Если рассматривать 1 моль вещества т.е. Ср и СV - молярные теплоемкости
dQV = CVdT, dQp = CpdT (6.45)
Для «n» моль вещества dQV = nCVdT, dQp = nCpdT
Исходя из выражения (6.45), находим
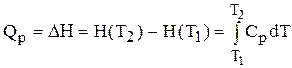 (6.46)
(6.46)
Зная зависимость теплоемкости вещества от температуры, по формуле (6.46) можно вычислить изменение энтальпии системы в интервале Т1¸Т2. В качестве базовой температуры выбирается Т1 = ОК или 298,15 К. В этом случае разность энтальпий Н(Т) – Н(298) называется высокотемпературной составляющей энтальпии.
Найдем связь между Ср и СV. Из выражений (6.43) и (6.44) можно записать:
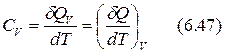
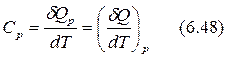
Из I закона термодинамики с учетом только механической работы для простой системы, для которой U = U(V,T)
dQ = dU + pdV = 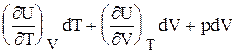
т.е. 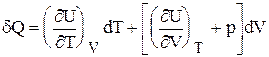 (6.49)
(6.49)
Подставим dQ из выражения (6.46) в (6.48) и (6.49) и получим:
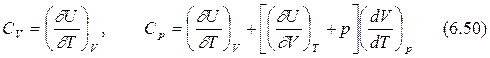
Для простой системы объем можно рассматривать как функцию давления и температуры, т.е.
V = V(p,T) ® dV = 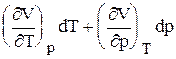
при условии p = constdp = 0, 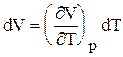
т.е. 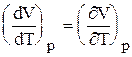
Отсюда 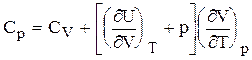 ,
,
Таким образом 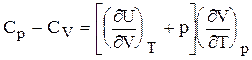 (6.51)
(6.51)
Для 1 моль идеального газа pV = RT, 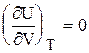
 Cp – CV =
Cp – CV = 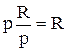
Для 1 моль реального газа и применение уравнения Ван-дер-Ваальса приводит к следующему выражению:
Cp– CV= 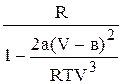
Для реальных газов Сp – CV > R. Эта разность увеличивается по мере увеличения давления, т.к. с увеличением давления растет 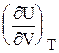 , связанное со взаимодействием молекул реального газа друг с другом.
, связанное со взаимодействием молекул реального газа друг с другом.
Для твердого тела при обычной температуре Сp – CV < R и составляет примерно 1 Дж/(моль . К). с понижением температуры разность Сp – CV уменьшается и при Т ® ОК Сp – CV ® 0.
Теплоемкость обладает свойством аддитивности, т.е. теплоемкость смеси двух веществ
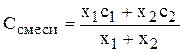 (6.52)
(6.52)
В общем случае
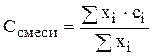 ,
,
где xi - доля веществ «I» в смеси.
Теплоемкость является одной из важнейших термодинамических характеристик индивидуальных веществ.
В настоящее время имеются точные методы измерения теплоемкости в широком интервале температур. Достаточно удовлетворительно разработана теория теплоемкости для простого твердого вещества при невысоких давлениях. Согласно молекулярно-кинетической теории теплоемкости для одного моль газа на каждую степень свободы приходится R/2. Т.е. поскольку молярная теплоемкость идеального газа при постоянном объеме
CV = Cn + Cв + Cк + Сэ, (6.53)
где Cn – теплоемкость газа, связанная с поступательным движением молекул,
Св – с вращательным,
Ск – с колебательным,
а Сэ – с электронными переходами, то для одноатомного идеального газа СV = 3/2R,
для двухатомных и линейных трехатомных молекул
CV = 5/2R + Cк
для нелинейных многоатомных молекул
CV = 3R + Ск
Теплоемкость Ск, связанная с колебательным движением атомов в молекуле, подчиняется законам квантовой механики и не отвечает закону равномерного распределения энергии по степеням свободы.
Сэ в формуле (6.53) не принимается во внимание, Сэ – это теплоемкость, связанная с электронными переходами в молекуле. Переход электронов на более высокий уровень под действием теплообмена возможен лишь при температурах выше 2000 К.
Теплоемкость твердых веществ с атомной кристаллической решет-кой можно вычислить по уравнению Дебая:
CV = CД(х), 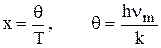 ,
,
где q – характеристическая температура;
nm – максимальная характеристическая частота колебания атомов в молекуле.
При повышении температуры CV твердых веществ с атомной кристаллической решеткой стремится к предельному значению CV ® 3R. При очень низких температурах
CV ~ T3 (T < q/12).
Теплоемкости Ср по опытным значениям CV (или наоборот) для веществ с атомной кристаллической решеткой можно рассчитать по уравнению:
Cp = СV (1 + 0,0214CV  )
)
Для сложного твердого или жидкого вещества хорошей теории пока не существует. Если экспериментальные данные по теплоемкости отсутствуют, то ее можно оценить с помощью эмпирических правил
1) Правило Дюлонга и Пти: атомная теплоемкость при постоянном объеме для любого простого твердого вещества приблизительно равна 25 Дж/(моль.К)
Правило выполняется при высоких температурах (близких к температуре плавления твердого вещества) для элементов, атомная масса которых больше, чем у калия. Как показал Больцман, оно может быть качественно обосновано кинетической теорией:
CV» 25 Дж/(моль.К)(3R)
2) Правило Неймана-Коппа (правило аддитивности) основывается на предположении о неизменяемости теплоемкости элементов при образовании химических связей
Ссв-ва = 25n
где n – число атомов, входящих в молекулу.
Более близкие к экспериментальным значениям теплоемкости получаются по правилу Неймана-Коппа, если принять для легких элементов значения атомных теплоемкостей представленные в табл. 6.1.
Таблица 6.1.
Значения атомных теплоемкостей для легких элементов
| Элемент | C | H | B | Si | O | F | S | P |
| Ср0, Дж/(моль.К) | 7,53 | 9,62 | 11,3 | 15,9 | 16,74 | 20,92 | 22,59 | 23,01 |
Для остальных элементов Cp0» 25,94 Дж/(моль.К).
3) Правило аддитивности лежит в основе формулы Келли, которая справедлива для высококипящих чистых неорганических жидкостей (BeO, BeCl2, MgBr2 и др.):
Ср = 32,43n;
где n – число атомов в молекуле, входящих в молекулу неорганического вещества.
У расплавленных элементов с d- и f-электронами Сат достигает 42¸50 Дж/(моль.К).
4) Приближенный метод расчета для органических жидкостей, использующий атомно-групповые составляющие теплоемкостей
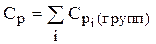
Последние получены при анализе опытных данных большого числа соединений, некоторые из которых сведены в табл. 6.2.
Таблица 6.2.
Некоторые значения атомно-групповых составляющих теплоемкостей
| Атом или группа | Ср, Дж/(моль.К) | Атом или группа | Ср, Дж/(моль.К) |
| –СН3 | 41,32 | –О– | 35,02 |
| –СН2– | 26,44 | –S– | 44,35 |
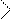 СН– СН– | 22,68 | –Cl | 35,98 |
| –СN | 58,16 | –Br | 15,48 |
| –ОН2 | 46,02 | C6H5– | 127,61 |
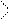 С=О(эфиры) С=О(эфиры) | 60,75 | –NH2(амины) | 63,6 |
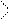 С=О(кетоны) С=О(кетоны) | 61,5 | –NO2 | 64,02 |
Зависимость теплоемкости от температуры
Теплоемкость твердых, жидких и газообразных веществ повышается с температурой. Только теплоемкости одноатомных газов практически не зависят от Т (например, He, Ar и другие благородные газы). Наиболее сложная зависимость С(Т) наблюдается у твердого вещества. Зависимость С(Т) изучается экспериментально, т.к. теория недостаточно разработана.
Обычно зависимость атомной и молярной теплоемкости от температуры выражается в виде интерполяционных уравнений.
Ср = а + в .Т + с .Т2 (для органических веществ) (6.53)
Ср = а + в .Т + с/ .Т-2 (для неорганических веществ)
Коэффициенты а, в, с, с/ - постоянные величины, характерные для данного вещества вычисляются на основании экспериментальных данных и справедливы в определенном интервале температур.
Теплоемкость - ϶ᴛᴏ свойство тел поглощать и выделять теплоту при изменении температуры на один градус в различных термодинамических процессах. Различают общую среднюю и общую истинную теплоемкости.
Общая средняя теплоемкость термодинамического процесса (ТП) - ϶ᴛᴏ теплоемкость тела массой m, кг за конечный отрезок ТП:
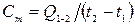 , [Дж/К].
, [Дж/К].
Общая истинная теплоемкость ТП - ϶ᴛᴏ теплоемкость тела массой m, кг в каждый данный момент ТП:
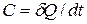 , [Дж/К].
, [Дж/К].
Рассмотрим произвольный ТП 1-2 в координатах 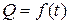 , где Q – подведенная теплота в [Дж]; t – температура в [0C]. Тогда
, где Q – подведенная теплота в [Дж]; t – температура в [0C]. Тогда 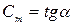 ,
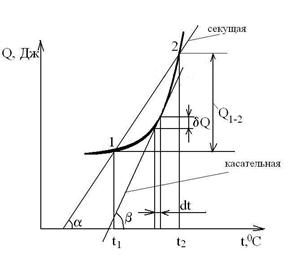
, 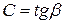 .
.
В случае если ТС – однородное рабочее тело, то в расчетах применяются относительные теплоемкости:
- удельная теплоемкость – теплоемкость, отнесенная к 1 кг вещества с=С/m, Дж/кгК;
- молярная теплоемкость – теплоемкость, отнесенная с 1 молю вещества 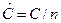 , Дж/мольК;
, Дж/мольК;
- объёмная теплоемкость – теплоемкость, отнесенная к 1м3 вещества 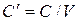 , Дж/м3К.
, Дж/м3К.
Теплоемкость – функция процесса и зависит от рода рабочего тела, характера процесса и параметров состояния. Так, теплоемкость в процессе с постоянным давлением принято называть изобарной теплоемкостью:
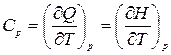 ,
,
где H, Дж – энтальпия.
Теплоемкость в процессе с постоянным объёмом принято называть изохорной теплоемкостью:
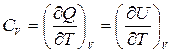 ,
,
где U, Дж – внутренняя энергия.
Теплоемкость идеального газа не зависит от температуры и давления и зависит только от числа степеней свободы движения молекул и в соответствии с законом о равном распределœении энергии по степеням свободы движения молекул теплоемкость: 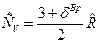 , где
, где  - вращательные степени свободы, равные для одноатомного газа нулю
- вращательные степени свободы, равные для одноатомного газа нулю  , для двухатомного газа -
, для двухатомного газа -  =2 и для трехатомных газов
=2 и для трехатомных газов  =3;
=3; 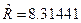 Дж/мольК – молярная газовая постоянная. Теплоемкость
Дж/мольК – молярная газовая постоянная. Теплоемкость 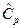 определяется по уравнению Майера:
определяется по уравнению Майера:
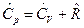 .
.
Для одноатомного газа 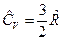 и
и 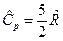 , для двухатомного газа
, для двухатомного газа 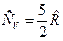 и
и 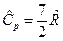 , для трех и более атомных газов
, для трех и более атомных газов 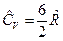 и
и 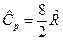 .
.
Теплоемкость реальных газов зависит от давления и температуры. В ряде случаев можно пренебречь влиянием давления на теплоемкость и принять, что теплоемкость реальных газов зависит только от температуры: C=f (t). Эта зависимость определяется экспериментально.
Эмпирическая зависимость удельной истинной теплоемкости от температуры должна быть представлена в виде многочлена:
 , Дж/кгК,
, Дж/кгК,
где 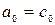 при температуре t =00C. Для двухатомных газов можно ограничиться двумя слагаемыми:
при температуре t =00C. Для двухатомных газов можно ограничиться двумя слагаемыми: 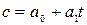 , или
, или 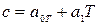 , где
, где 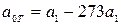 .
.
Для конечного участка процесса 1-2 количество теплоты равно:
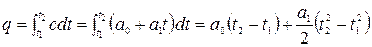 .
.
Тогда средняя теплоемкость на этом участке процесса будет равна:
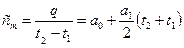 , Дж/кгК.
, Дж/кгК.
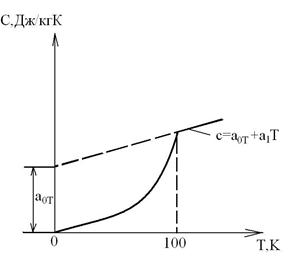
В области низких температур при Т <100К прекращается вращательное движение молекул и колебательное движение атомов, а при температуре Т →0К прекращается и поступательное движение молекул, ᴛ.ᴇ. при Т =0К Ср=Cv =0 и прекращается тепловое движение молекул (опытные данные Нернста и др., 1906-1912гᴦ.). При температуре Т →0К свойства веществ перестают зависеть от температуры, как это иллюстрируется на приведенном графике зависимости теплоемкости от абсолютной температуры.
 2017-12-14
2017-12-14 9687
9687
