Завдання 1
Підберіть коефіцієнти у рівнянні окисно-відновної реакції методами зміни ступенів окиснення та напівреакцій, вкажіть напівреакції окиснення і відновлення:
1) Cu + HNO3 (розв) = Cu(NO3)2 + NO + H2O;
2) KMnO4 + Na2SO3 + H2SO4 = MnSO4 + Na2SO4 + K2SO4 + H2O;
3) NaBiO3 + Na2SO3 + H2SO4 = Bi2(SO4)3 + Na2SO4 + H2O;
4) H2O2 + KMnO4 + H2SO4 = MnSO4 + K2SO4 + O2 + H2O;
5) FeSO4 + HNO3 + H2SO4 = Fe2(SO4)3 + NO + H2O;
6) MnSO4 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + PbSO4 + H2O;
7) Na2SO3 + K2Cr2O7 + H2SO4 = Cr2 (SO4)3 + Na2SO4 + K2SO4 + H2O;
8) NaNO2 + KMnO4 + H2SO4 = MnSO4 + NaNO3 + K2SO4 + H2O;
9) KBiO3 + MnSO4 + H2SO4 = Bi2(SO4)3 + K2SO4 + KMnO4 + H2O;
10) KNO3 + MnO2 + KOH = K2MnO4 + KNO2 + H2O;
11) HCl + K2Cr2O7 = KCl + CrCl3 + Cl2 + H2O;
12) Cr2(SO4)3 + H2O2 + KOH = K2CrO4 + K2SO4 + H2O;
13) KNO2 + KMnO4 + H2O = KNO3 + MnO2 + HNO3;
14) NaClO3 + MnO2 + NaOH = Na2MnO4 + NaCl + H2O;
15) SO2 + HClO4 + H2O = HCl + H2SO4.
Завдання 2
Обчисліть ЕРС гальванічного елемента, складеного з таких електродів, та запишіть напівреакції анодного і катодного процесів:
1) мідний електрод, занурений в 0,02 М розчин Cu(NO3)2, а цинковий –
у 0,02 М розчин Zn(NO3)2;
2) мідний електрод, занурений в 0,01 М розчин Cu(NO3)2, а залізний –
у 0,02 М розчин FeSO4;
3) срібний електрод, занурений в 0,02 М розчин AgNO3, а цинковий –
у 0,02 М розчин ZnSO4;
4) кадмієвий електрод, занурений в 0,03 М розчин Cd(NO3)2, а алюмі-нієвий – в 0,03 М розчин AlCl3;
5) золотий електрод, занурений в 0,02 М розчин AuCl3, а цинковий –
у 0,01 М розчин Zn(NO3)2;
6) нікелевий електрод, занурений в 0,03 М розчин NiSO4, а залізний –
у 0,04 М розчин FeCl2;
7) один олов’яний електрод, занурений в 2 М розчин Sn(NO3)2, а другий – у 0,1 М розчин Sn(NO3)2;
8) срібний електрод, занурений в 0,25 М розчин AgNO3, а платиновий –
у 1 М розчин Pt(NO3)2;
9) олов’яний електрод, занурений в 0,5 М розчин Sn(NO3)2, а cвинцевий –
у 1 М розчин Pb (NO3)2;
10) мідний електрод, занурений в 2 М розчин Cu(NO3)2, а цинковий –
у 0,5 М розчин Zn(NO3)2;
11) срібний електрод, занурений в 0,5 М розчин AgNO3, а нікелевий –
у 0,5 М розчин NiSO4;
12) нікелевий електрод, занурений в 0,5 М розчин Ni(NO3)2, а залізний –
у 0,05 М розчин Fe(NO3)2;
13) один платиновий електрод, занурений в 2 М розчин Pt(NO3)2, а другий – у 0,02 М розчин Pt(NO3)2;
14) золотий електрод, занурений в 1 М розчин AuCl3, а мідний –
у 0,5 М розчин Cu(NO3)2;
15) один срібний електрод, занурений в 2 М розчин AgNO3, а другий –
у 0,2 М розчин AgNO3.
Завдання 3
1. Через розчин мідного купоросу пропустили 1 А´год електрики. Скільки грамів міді виділилося на катоді?
2. Яка маса алюмінію виділиться на катоді при електролізі розплаву алюміній хлориду протягом 1 год за сили струму 10 А?
3. Якої сили повинен бути струм, щоб електролізом з розчину арґентум нітрату виділити срібло масою 1,08 г за 6 хв?
4. Через розчин цинк хлориду пропустили 96500 Кл електрики. При цьому виділилося 19,61 г цинку і 32,00 г хлору. Чому дорівнює вихід цих речовин за струмом? Запишіть рівняння катодного і анодного процесів.
5. Струм силою 2 А протягом 1 год 28 хв виділив на катоді 6,5 г металу (вважати, що вихід за струмом 100 %). Обчисліть молярну масу еквівалента металу.
6. Яка кількість електрики (Кл) необхідна, щоб повністю виділити нікелю з розчину, що містить його сульфат масою 30,9 г?
7. Під час електролізу розчину СuСl2 на аноді виділилося 560 мл газу (н.у.). Обчисліть, яка маса міді виділилася на катоді.
8. Яка маса срібла виділиться на катоді при пропусканні струму силою 6 А через розчин аргентум нітрату впродовж 30 хв?
9. Обчисліть, який об’єм кисню (н.у.) виділиться при пропусканні струму силою 6 А впродовж 30 хв через водний розчин KOH. Запишіть рівняння катодного і анодного процесів.
10. Обчисліть об’єм водню (н.у.), який виділиться при пропусканні струму силою 3 А впродовж 1 год через водний розчин сульфатної кислоти.
11. За 10 хв з розчину солі платини струм силою 5 А виділив 1,517 г платини. Обчисліть молярну масу еквівалента платини.
12. Яка молярна маса еквівалента кадмію, якщо для виділення 1 г кадмію з розчину його солі потрібно пропустити через розчин 1717 Кл електрики?
13. При проходженні через розчин солі тривалентного металу струму силою 1,5 А упродовж 30 хв на катоді виділилося 1,071 г цього металу. Обчисліть атомну масу металу.
14. При електролізі водного розчину Cr2(SO4)3 струмом силою 2 А маса катода збільшилася на 8 г. Упродовж якого часу проводили електро-ліз?
15. Під час електролізу водного розчину SnCl2 на аноді виділилося 4,48 л хлору (н.у.). Обчисліть, яка маса олова виділилася на катоді. Запишіть рівняння катодного і анодного процесів.
ДОДАТКИ
Таблиця 1
СТАНДАРТНІ ЕНТАЛЬПІЇ  І ЕНЕРГІЇ ГІББСА
І ЕНЕРГІЇ ГІББСА  (кДж/моль) УТВОРЕННЯ ТА АБСОЛЮТНІ ЕНТРОПІЇ
(кДж/моль) УТВОРЕННЯ ТА АБСОЛЮТНІ ЕНТРОПІЇ  (Дж/(К∙моль))
(Дж/(К∙моль))
ДЕЯКИХ РЕЧОВИН ЗА 25 оС
| Речовина |  |  |  | Речовина |  |  |  |
| AgCl | –127,2 | –109,9 | 96,2 | KBr | –392,2 | –379,2 | 96,4 |
| Al2O3 | –1676,8 | –1583,3 | 51,0 | KI | –327,6 | –322,3 | 104,3 |
| Al2S3 | –509,0 | –23,0 | 96,2 | KClO3 | –391,2 | –289,9 | 143,0 |
| BaCl2 | –859,1 | –811,4 | 123,8 | LiCl | –408,3 | –384,0 | 59,3 |
| BaO | –553,9 | –525,4 | 70,5 | MgCl2 | –641,1 | –591,6 | 89,8 |
| C (алмаз) | +1,828 | +2,834 | 2,37 | MgO | –601,8 | –569,6 | 26,9 |
| С (графіт) | 5,74 | N2 | 199,9 | ||||
| С2Н2 (г) | +226,7 | +116,8 | 200,8 | NH4Cl | –314,2 | –302,2 | 94,6 |
| СOCl2 (г) | –219,5 | –205,3 | 2283,6 | NH3 | –46,2 | –16,7 | 192,6 |
| СО | –110,6 | –137,2 | 197,7 | NO | +90,3 | +80,6 | 210,7 |
| СO2 | –393,8 | –394,6 | 213,8 | NO2 | +33,0 | +51,5 | 240,2 |
| CS2 (p) | +88,7 | +64,4 | 151,0 | NaCl | –411,1 | –384,0 | 72,1 |
| CaC2 | –59,9 | –64,9 | 70,0 | Na2CO3 | –1137 | –1047 | 136,4 |
| CaCO3 | –1207,7 | –1129,6 | 91,6 | NiO | –239,7 | –211,6 | 38,0 |
| CaCl2 | –796,3 | –748,9 | 104,7 | O2 | 205,0 | ||
| CaO | –635,0 | –603,6 | 39,7 | O3 | 142,3 | 162,7 | 238,8 |
| Ca(OH)2 | –986,8 | –899,2 | 83,4 | P (біл.) | 41,1 | ||
| Cl2 | 222,9 | P (черв.) | –17,6 | 12,1 | 22,8 | ||
| CuCl2 | –215,7 | –171,5 | 108,2 | PCl3 | –287,0 | –260,5 | 311,7 |
| CH4 | –75,0 | –50,9 | 186,0 | PCl5 | –374,9 | –305,4 | 364,5 |
| CuO | –156,0 | –129,9 | 42,6 | P4O10 | –3014 | –2743 | 280,6 |
| Fe | 27,2 | H3PO4 | –1267 | –1134 | 200,8 | ||
| FeCl3 | –399,7 | –334,2 | 142,4 | PbO | –219,3 | –189,1 | 66,1 |
| FeO | –265,0 | –244,5 | 60,8 | PbO2 | –276,6 | –218,3 | 74,9 |
| Fe2O3 | –822,7 | –740,8 | 87,5 | SO3 (г) | –395,9 | –317,2 | 256,7 |
| Fe3O4 | –1117,9 | –1014,8 | 146,3 | SO2 | –297,2 | –300,4 | 248,2 |
| H2 | 130,7 | H2S | –21,0 | –33,8 | 205,7 | ||
| HCl (г) | –92,4 | –94,5 | 186,9 | H2SO4 | –814,2 | –690,3 | 156,9 |
| H2O (г) | –242,0 | –228,8 | 188,9 | SiO2 | –911,6 | –857,2 | 41,9 |
| Речовина |  |  |  | Речовина |  |  |  |
| H2O (к) | –286,4 | –298,4 | 44,1 | SnO2 | –580,8 | –519,3 | 52,3 |
| H2O (р) | –286,0 | –237,4 | 70,0 | TiO2 | –943,9 | –888,6 | 50,3 |
| H2O2 (р) | –187,9 | –120,5 | 109,6 | ZnS | –205,6 | –200,9 | 57,8 |
| HF (г) | –268,0 | –270,7 | 173,5 | ZnO | –348,0 | –318,2 | 43,9 |
| KCl | –435,9 | –408,0 | 82,6 | ZnCl2 | –415,3 | –369,6 | 111,5 |
Таблиця 2
КОНСТАНТИ ДИСОЦІАЦІЇ ДЕЯКИХ СЛАБКИХ
КИСЛОТ І ОСНОВ У ВОДНИХ РОЗЧИНАХ ЗА 25 оС
| Кислота/основа | Формула | Константи дисоціації |
| Аміак | NH3 ´ H2О | K = 1,8×10–5 |
| Арсенатна кислота | H3AsO4 | K1 = 5,6×10–3 K2 = 1,7×10–7 K3 = 2,95×10–12 |
| Арсенітна кислота | H3AsO3 | K1 = 5,8×10–10 K2 = 3,2×10–14 |
| Ацетатна кислота | CH3COOH | K = 1,8×10–5 |
| Карбонатна кислота | H2CO3 | K1 = 4,5×10–7 K2 = 4,8×10–11 |
| Боратна (орто) кислота | H3BO3 | K1 = 7,1×10–10 K2 = 1,8×10–13 K3 = 1,6×10–14 |
| Гідразин | N2H4 ´ H2О | K = 9,3×10–7 |
| Гідроген пероксид | H2О2 | K = 2,0 × 10–12 |
| Нітритна кислота | HNO2 | K = 5,1×10–4 |
| Оксалатна кислота | H2C2O4 | K1 = 5,6×10–2 K2 = 5,4×0–5 |
| Сульфідна кислота | H2S | K1= 1,0×10–7 K2 = 1,23×10–18 |
| Сульфітна кислота | H2SO3 | K1 = 1,7×10–2 K2 = 6,2×10–8 |
| Флуоридна кислота | HF | K1 = 6,8×10–4 |
| Форміатна кислота | HCOOH | K = 1,8×10–4 |
| Фосфатна (орто) кислота | H3PO4 | K1 = 7,6×10–3 K2 = 6,2×10–8 K3 = 4,2×10–13 |
| Ціанідна кислота | HCN | K = 7,9×10–10 |
Таблиця 3
ДОБУТКИ РОЗЧИННОСТІ
ДЕЯКИХ МАЛОРОЗЧИННИХ РЕЧОВИН ЗА 25 ОС
| Речовина | ДР | Речовина | ДР |
| AgBr | 6,3 × 10–13 | Fe(OH)2 | 1,0 × 10–15 |
| AgCl | 1,8 × 10–10 | Fe(OH)3 | 3,2 × 10–38 |
| Ag2CrO4 | 1,1 × 10–12 | FeCO3 | 3,5 × 10–11 |
| AgI | 8,3 × 10–17 | FeS | 5,0 × 10–18 |
| Ag2S | 6,3 × 10–50 | Hg2S | 1,0 × 10–47 |
| Ag2SO4 | 1,6 × 10–5 | HgS (чорн.) | 1,6 × 10–52 |
| Al(OH)3 | 1,0 × 10–32 | MgCO3 | 2,1 × 10–5 |
| BaCO3 | 5,1 × 10–9 | MnS | 2,5 × 10–10 |
| BaCrO4 | 1,2 × 10–10 | NiS | 1,0 × 10–24 |
| BaSO4 | 1,1 × 10–10 | PbBr2 | 9,1 × 10–6 |
| CaCO3 | 4,8 × 10–9 | PbCl2 | 1,6 × 10–5 |
| CaC2O4 | 2,3× 10–9 | PbІ2 | 1,1 × 10–9 |
| CaF2 | 4,0 × 10–11 | PbS | 2,5 × 10–27 |
| CaSO4 | 1,3 × 10–4 | PbCrO4 | 1,8 × 10–14 |
| Сa3(PO4)2 | 2,0 × 10–29 | PbSO4 | 1,6 × 10–8 |
| Сd(OH)2 | 2,2 × 10–14 | Sn(OH)2 | 6,3 × 10–27 |
| CdS | 7,9 × 10–27 | Sn(OH)4 | 1 × 10–57 |
| CoS | 2,0 × 10–25 | SrCO3 | 1,1 × 10–10 |
| Cu(OH)2 | 2,2 × 10–20 | SrSO4 | 3,2 × 10–7 |
| CuS | 6,3 × 10–36 | Zn(OH)2 | 1,2 × 10–17 |
| Сu2S | 2,5 × 10–48 | ZnS | 1,6 × 10–24 |
Таблиця 4
СТАНДАРТНІ ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ E 0
ДЕЯКИХ ОКИСНО-ВІДНОВНИХ СИСТЕМ У ВОДНИХ РОЗЧИНАХ
| Електродний процес | Е 0, B | Електродний процес | Е 0, B |
| Li+ + 1 ē = Li | –3,045 | Cu2+ + 1 ē = Cu+ | +0,158 |
| Rb+ + 1 ē = Rb | –2,295 | Сu2+ + 2 ē = Cu | +0,337 |
| K+ + 1 ē = K | –2,924 | 2H2O + O2 + 4 ē = 4OH– | +0,401 |
| Cs+ + 1 ē = Cs | –2,923 | I2 + 2 ē = 2I– | +0,536 |
| Ba2+ + 2 ē = Ba | –2,90 |  + 1 ē = + 1 ē =  | +0,564 |
| Ca2+ + 2 ē = Ca | –2,866 |  + 2H2O + 3 ē = MnO2 + 4OH– + 2H2O + 3 ē = MnO2 + 4OH– | +0,588 |
| Na+ + 1 ē = Na | –2,714 | O2 + 2H+ + 2 ē = H2O2 | +0,682 |
| Mg2+ + 2 ē = Mg | –2,363 | Fe3+ + 1 ē = Fe2 + | +0,771 |
| Al3+ + 3 ē = Al | –1,663 | Ag+ + 1 ē = Ag | +0,799 |
| Mn2+ + 2 ē = Mn | –1,192 | Hg 2+ + 2 ē = Hg | +0,852 |
| Cr2+ + 2 ē = Cr | –0,852 |  + 10H+ + 8 ē = + 10H+ + 8 ē = 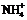 + 3H2O + 3H2O | +0,880 |
| Zn2+ + 2 ē = Zn | –0,763 | HNO2 + H+ +1 ē = NO + H2O | +1,000 |
| Cr3+ + 3 ē = Cr | –0,744 | Br2 + 2 ē = 2  | +1,087 |
| Fe2+ + 2 ē = Fe | –0,440 | O2 + 4H+ + 4 ē = 2H2O | +1,229 |
| Cd2+ + 2 ē = Cd | –0,403 | MnO2 + 4H+ + 2 ē = Mn2 + + 2H2O | +1,228 |
| Co2+ + 2 ē = Co | –0,277 |  + 14H+ + 6 ē = 2Cr3 + + 7H2O + 14H+ + 6 ē = 2Cr3 + + 7H2O | +1,333 |
| Ni2+ + 2 ē = Ni | –0,250 | Cl2 + 2 ē = 2Cl- | +1,359 |
| Sn2+ + 2 ē = Sn | –0,136 | PbO2 + 4H+ + 2 ē = Pb2+ + 2H2O | +1,455 |
| Pb2+ + 2 ē = Pb | –0,126 | Au3 + + 3 ē = Au | +1,498 |
 + 4H2O + 3 ē = Cr3+ + 8OH– + 4H2O + 3 ē = Cr3+ + 8OH– | –0,125 |  + 8H+ + 5 ē = Mn2 + + 4H2O + 8H+ + 5 ē = Mn2 + + 4H2O | +1,507 |
| Fe3+ + 3 ē = Fe | –0,037 |  + 4H+ + 3 ē = MnO2 + 2H2O + 4H+ + 3 ē = MnO2 + 2H2O | +1,692 |
| 2H+ + 2 ē = H2 | 0,000 | H2O2 + 2H+ +2 ē = 2H2O | +1,776 |
| Sn4 + + 2 ē = Sn2+ | +0,15 | F2 + 2 ē = 2F– | +2,870 |
Рекомендована література
Основна:
1. Жак О.В., Каличак Я.М. Загальна хімія. – Львів: Видав. центр ЛНУ ім. І. Франка, 2010. – 368 с.
2. Григор’єва В.В., Самійленко В.М., Сич А.М. Загальна хімія. – К.: Вища шк., 1991. – 461 с.
3. Каличак Я.М., Кінжибало В.В., Котур Б.Я., Миськів М.Г., Сколоздра Р.В. Хімія. Задачі, вправи, тести. – Львів: ВЦ ЛНУ ім. І. Франка, 1999. – 168 с.
4. Котур Б.Я. Хімія. Практикум. – Львів: ВЦ ЛНУ ім. І. Франка, 2004. – 237 с.
5. Ломницька Я., Чабан Н., Кузьма Ю. Лабораторний практикум з аналітичної хімії. – Львів: Видав. центр ЛНУ ім. І. Франка, 2004.
6. Луцевич Д.Д. Довідник з хімії. – Львів: НВФ “Українські техно-логії”, 2008. – 430 с.
7. Неділько С.А., Попель П.П. Загальна й неорганічна хімія. Задачі та вправи. – К.: Либідь, 2001. – 400 c.
8. Романова Н.В. Загальна та неорганічна хімія. – К.: Перун, 2010. – 480 с.
9. Телегус В.С., Бодак О.І., Заречнюк О.С., Кінжибало В.В. Основи за-гальної хімії. – Львів: Світ, 2000. – 424 c.
10. Яворський В.Т. Основи теоретичної хімії. – Львів: ВЦ Нац. ун-ту “Львівська політехніка”, 2008. – 348 с.
Додаткова:
1. Алексеенко В.А. Экологическая геохимия. – М.: Логос, 2000. – 627 с.
2. Башкин В.М. Биогеохимия. – М.: Научный мир, 2004. – 584 с.
3. Блинов Л.Н. Химико-экологический словарь-справочник.– СПб.: Лань, 2002. – 272 c.
4. Добровольский В.В. Основы биогеохимии. – М.: Высшая школа, 1998. – 413 с.
5. Глинка Н.Л. Общая химия. – Л.: Химия, 1983. – 703 с.
6. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 1986. – 272 с.
7. Зарицкий П.В. Геохимия окружающей среды. – Харьков: ХНУ, 2001. – 152 с.
8. Коровин Н.В. Общая химия. – М.: Высшая школа, 1998. – 446 с.
9. Корчинський Г.А. Хімія. – Вінниця: Поділля, 2002. – 525 с.
10. Общая химия / Под ред. Е.М. Соколовской, Л.С. Гузея. – М.: Изд-во Моск. ун-та, 1989. – 640 с.
11. Полинг Л. Общая химия. – М: Мир, 1974. – 846 с.
12. Степаненко О.М., Рейтер Л.Г., Лєдовських В.М., Іванов С.В. Загальна та неорганічна хімія. – К.: Пед. преса, 2002. – У 2-х ч. – Ч. 1. – 520 с.
13. Хомченко И.Г. Общая химия. – М.: Химия, 1987. – 464 с.
 2018-01-08
2018-01-08 1254
1254







