1. Закінчіть вислів: Енергія активації – це...
а) надлишкова енергія, якою повинні володіти реагуючі молекули для того, щоб зіткнення між ними призводило до утворення нової речовини;
б) енергія, яка виділяється внаслідок хімічної реакції;
в) енергія, яку необхідно витратити, щоб розірвати хімічний зв’язок;
г) енергія, яка виділяється при утворенні нового хімічного зв’язку.
2. Яка термодинамічна функція характеризує ступінь невпорядкованості
у системі?
а) ентальпія; б) внутрішня енергія;
в) ентропія; г) вільна енергія Гіббса.
3. Яка термодинамічна функція характеризує тепловміст системи?
а) ентальпія; б) внутрішня енергія;
в) ентропія; г) вільна енергія Гіббса.
4. Закінчіть вислів: Каталізатор – це...
а) речовина, яка збільшує швидкість хімічної реакції, при цьому кількісно і якісно змінюється;
б) речовина, яка збільшує швидкість хімічної реакції, при цьому кількісно і якісно не змінюється;
в) речовина, яка зменшує швидкість хімічної реакції, при цьому кількісно і якісно змінюється.
5. Від яких чинників залежить швидкість хімічної реакції?
а) від концентрації і природи реагуючих речовин, їхньої маси і тем-ператури;
б) від природи і концентрації реагуючих речовин, температури і на-явності каталізатора;
в) від зовнішнього тиску і температури;
г) від концентрації реагуючих речовин, зовнішнього тику, наявності каталізатора.
6. Закінчіть вислів: Реакції, які відбуваються з поглинанням теплоти,
називаються...
а) екзотермічними; б) ендотермічними; в) окисно-відновними;
г) оборотними; д) каталітичними.
7. Закінчіть вислів: Реакції, які відбуваються з виділенням теплоти,
називаються...
а) екзотермічними; б) ендотермічними; в) окисно-відновними;
г) оборотними; д) каталітичними
8. Що називають швидкістю реакції?
а) зміну об’єму реагуючих речовин в розчині;
б) число елементарних актів взаємодії за одиницю часу в одиниці об’єму;
в) зміну маси частинок в розчині;
г) зміну кількості частинок в розчині
9. Сформулюйте закон дії мас:
а) швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин;
б) швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам;
в) швидкість хімічної реакції пропорційна сумі концентрацій реагуючих речовин;
г) швидкість хімічної реакції пропорційна сумі концентрацій реагуючих речовин у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам.
10. Сформулюйте правило Вант-Гоффа:
а) при підвищенні температури на кожні 10 градусів швидкість хімічної реакції збільшується у 2-4 рази;
б) при підвищенні температури на кожні 10 градусів швидкість хімічної реакції зменшується у 2-4 рази;
в) при підвищенні температури швидкість хімічної реакції не змінюється;
г) при підвищенні температури швидкість хімічної реакції змінюється пропорційно до зростання тиску.
11. Закінчіть вислів: Каталітичні реакції - це реакції,...
а) які відбуваються з поглинанням теплоти;
б) які відбуваються одночасно в обох напрямках;
в) які відбуваються з виділенням теплоти;
г) під час яких відбувається окиснення речовин з виділенням теплоти і світла;
д) які відбуваються за наявності каталізаторів.
12. Закінчіть вислів: Необоротними називаються реакції, які...
а) відбуваються з виділенням теплоти;
б) відбуваються лише в одному напрямку до моменту повної витрати одного з реагентів;
в) не відбуваються до кінця, при цьому жоден з реагентів не витра-чається повністю;
г) прискорюються унаслідок уведення в реакційну систему каталі-затора.
13. Що називають хімічною рівновагою?
а) стан реагуючої системи, за якого швидкість прямої реакції більша, ніж швидкість зворотної;
б) стан реагуючої системи, за якого швидкість прямої реакції менша, ніж швидкість зворотної;
в) стан реагуючої системи, за якого швидкість прямої реакції дорів-нює швидкості зворотної;
г) стан реагуючої системи, за якого пряма реакція припиняється.
14. Яку величину називають константою хімічної рівноваги?
а) відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степе-нях, що дорівнюють їхнім стехіометричним коефіцієнтам;
б) відношення суми рівноважних концентрацій продуктів реакції до суми рівноважних концентрацій вихідних речовин у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам;
в) відношення суми рівноважних концентрацій вихідних речовин до суми рівноважних концентрацій продуктів реакції у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам;
г) відношення добутку рівноважних концентрацій вихідних речовин до добутку рівноважних концентрацій продуктів реакції у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам.
15. Сформулюйте правило Ле Шательє:
а) якщо на систему, що знаходиться у стані хімічної рівноваги, по-діяти ззовні, то рівновага не зміститься взагалі;
б) якщо на систему, що знаходиться у стані хімічної рівноваги, по-діяти ззовні, то рівновага зміститься у бік тієї реакції, яка послаблює цей зовнішній вплив;
в) якщо на систему, що знаходиться у стані хімічної рівноваги, по-діяти ззовні, то рівновага зміститься у бік тієї реакції, яка підсилює цей зовнішній вплив.
16. У чому полягає фізичний зміст константи швидкості реакції?
а) чисельно дорівнює швидкості реакції за стандартних умов;
б) чисельно дорівнює швидкості реакції, коли концентрації реагую-чих речовин дорівнюють 1 моль/л;
в) чисельно дорівнює швидкості реакції за нормальних умов;
г) чисельно дорівнює швидкості реакції у стані хімічної рівноваги.
17. Що таке молекулярність реакції?
а) кількість частинок, які беруть участь у елементарному акті хіміч-ної взаємодії;
б) кількість частинок, що утворюються унаслідок хімічної взаємо-дії;
в) сума кількості частинок вихідних речовин та продуктів реакції;
г) добуток кількості частинок вихідних речовин та продуктів реак-ції.
18. Як зміститься стан рівноваги реакції 2NO(г) + O2(г) = 2NO2(г) при
збільшенні тиску:
а) в бік утворення продуктів; б) в бік утворення вихідних речовин;
в) зміна тиску не вплине на стан рівноваги цієї реакції.
19. Які чинники зсуватимуть рівновагу реакції 3H2 + N2 = 2NH3,
D H o = – 92 кДж/моль, в бік утворення аміаку?
а) збільшення тиску; б) зниження температури;
в) підвищення температури; г) зниження тиску;
д) збільшення концентрації водню.
20. У скільки разів зросте швидкість реакції при підвищенні темпера-
тури від 30 оС до 60 оС, якщо температурний коефіцієнт реакції
дорівнює 3?
а) 3; б) 9; в) 18; г) 30; д) 33.
21. Як зміниться швидкість реакції 2SO2(г) + О2(г) = 2SO3(г) при збіль-
шенні концентрації SO2 в 3 рази?
а) збільшиться в 3 рази; б) збільшиться в 6 разів;
в) збільшиться в 9 разів; г) збільшиться в 27 разів.
23. Поставте у відповідність назви законів їхнім формулюванням:
| 1) перший закон термодинаміки | а) зміна енергії системи в разі переходу з одного стану в інший не залежить від шляху процесу, а залежить лише від початкового і кінцевого стану системи; |
| 2) другий закон термодинаміки | б) тепловий ефект реакції за сталого тиску не залежить від шляху переходу системи з одного стану в інший і визначена тільки початковим та кінцевим станами речовин, що вступають у реакцію і утворюються внаслідок реакції; |
| 3) перший закон термохімії (закон Лавуазьє-Лапласа) | в) хімічні реакції, які відбуваються без підведення теплоти ззовні, проходять у напрямі максимального виділення теплоти, тобто є екзотермічними; |
| 4) другий закон термохімії (закон Гесса) | г) в ізольованих системах ентропія самовільного процесу зростає; |
| д) теплота розкладання конкретної сполуки чисельно дорівнює теплоті її утворення, але має протилежний знак. |
22. Посортуйте наведені реакції за молекулярністю:
| 1) мономолекулярна | а) 2NO + O2 = 2NO2 |
| 2) димолекулярна | б) H2 + I2 = 2HI |
| 3) тримолекулярна | в) N2O5 = NO2 + NO + O2 |
| г) 3H2 + N2 = 2NH3 |
24. Запишіть вираз константи рівноваги для реакції S (тв.) + O2 (г) = SO2 (г)
а)  ; б)
; б)  ; в)
; в) 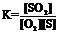 ; г)
; г) 
25. Як вплине на стан рівноваги реакції S (тв.) + O2 (г) = SO2 (г) збільшення
тиску?
А) рівновага зміститься у бік утворення сульфур в.сину;
б) рівновага зміститься у бік розкладання сульфур діоксину;
в) рівновага не зміститься взагалі.
26. Як вплине на стан рівноваги реакції S (тв) + O2 (г) = SO2 (г) зменшення
концентрації SO2?
А) рівновага зміститься у бік утворення сульфур діоксиду;
б) рівновага зміститься у бік розкладання сульфур діоксину;
в) рівновага не зміститься взагалі.
27. Як зміниться швидкість реакції при зниженні температури від 70 oС
до 30 oС, якщо температурний коефіцієнт реакції дорівнює 2?
а) збільшиться у 2 рази; б) зменшиться у 16 разів;
в) зменшиться у 8 разів; г) збільшиться у 16 разів; д) не зміниться.
28. Як зміниться швидкість реакції при нагріванні реагуючих речовин від
20 oС до 80 oС, якщо температурний коефіцієнт реакції дорівнює 2?
а) збільшиться у 2 рази; б) зменшиться у 16 разів;
в) збільшиться у 64 рази; г) зменшиться у 64 рази; д) не зміниться.
29. Як зміниться швидкість реакції при охолодженні реакційної суміші від
100 oС до 50 oС, якщо температурний коефіцієнт реакції дорівнює 3?
а) збільшиться у 81 раз; б) зменшиться у 3 рази;
в) збільшиться у 243 рази; г) збільшиться у 9 разів; д) не зміниться.
 2018-01-08
2018-01-08 1174
1174








