Основное уравнение МКТ идеального газа

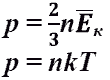 основное уравнение МКТ идеального газа. Выведено в предположении, что давление газа есть результат ударов его молекул о стенки сосуда. Это же уравнение в другой записи. p - давление Па = Н/м2 n - концентрация газа 1/м3 k = 1,38. 10-23 Дж/К m0 - масса молукулы кг v - средняя скорость молекул м/с T - абсолютная температура газа (to + 273) К Eк - средняя кинетическая энергия молекул газа Дж.
основное уравнение МКТ идеального газа. Выведено в предположении, что давление газа есть результат ударов его молекул о стенки сосуда. Это же уравнение в другой записи. p - давление Па = Н/м2 n - концентрация газа 1/м3 k = 1,38. 10-23 Дж/К m0 - масса молукулы кг v - средняя скорость молекул м/с T - абсолютная температура газа (to + 273) К Eк - средняя кинетическая энергия молекул газа Дж.
Уравнение состояния идеального газа
Используя зависимость давления идеального газа от его температуры и концентрации молекул p = nkT,можно найти связь между основными макроскопическими параметрами газа — объемом V, его давлением p и температурой T.
Концентрация n молекул газа равна 
где N — число молекул газа в сосуде объемом V. Число N можно выразить как произведение количества вещества на постоянную Авогадро NA: 
Из выражений получаем 
Произведение постоянной Авогадро NA на постоянную Больцмана k называется молярной газовой постоянной R. Молярная газовая постоянная равна
 Используя молярную газовую постоянную, выражение (26.3) преобразуем в уравнение
Используя молярную газовую постоянную, выражение (26.3) преобразуем в уравнение 
Количество вещества можно найти, зная массу вещества m и его молярную массу M:
 поэтому уравнение можно записать в такой форме:
поэтому уравнение можно записать в такой форме:
 Это уравнение называется уравнением состояния идеального газа.
Это уравнение называется уравнением состояния идеального газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газов, было получено французским физиком Бенуа Клапейроном (1799—1864). В форме (26.7) его впервые применил великий русский ученый Дмитрий Иванович Менделеев (1834—1907), поэтому уравнение состояния газа называется уравнением Менделеева — Клапейрона.
Закон Дальтона
В смеси газов, химически не реагирующих между собой, каждый компонент ведет себя независимо от других, то есть он сохраняет все свои физические свойства независимо от того, сколько других газов находится в смеси с ним. Важнейшие следствия закона Дальтона:
■ общее давление газовой смеси Р равно сумме парциальных давлений р, всех входящих в нее газов: Р = Σрi
■ парциальное давление отдельных компонентов в смеси равно произведению его мольной (объемной) концентрации у на общее давление смеси:
p i =yi x P = (vi/V)x P
■ при приведении объемов отдельных газов к общему давлению парциальные объемы их v, в сумме дают общий объем V, соответствующий давлению Р: V = Σ vi;.
■ при растворении газовых смесей каждый газ растворяется независимо от других газов пропорционально своему парциальному давлению.
Реальные газы значительно отклоняются от закона Дальтона.


Билет №23.
 2018-01-08
2018-01-08 2437
2437
