Задача 1. В баллоне объёмом 20л находится аргон под давлением 1,0 Мпа и температуре 300 К. После того как из баллона было взято 20,0 г аргона, температура в баллоне понизилась до 280 К. Определить давление газа, оставшегося в баллоне.
Решение:
Для решения задачи воспользуемся уравнением состояния идеального газа, применив его к начальному и конечному состояниям газа:
 , (1)
, (1)
 . (2)
. (2)
Из уравнений (1) и (2) выразим m1 и m2 и найдём их разность:
 ,
,
откуда находим
 (3)
(3)
Проверку решения проведем по размерности физических величин. В правую часть вместо символов величин подставим их единицы измерения. В правой части два слагаемых. Первое из них имеет размерность давления, так как состоит из двух множителей, первый из которых – давление, а второй – безразмерный. Проверим второе слагаемое:
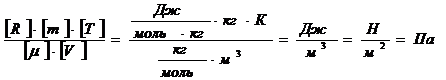
Вычисления произведём по формуле (3) с учётом, что для аргона  кг/моль.
кг/моль.
 .
.
Ответ: 875 кПа.
Задача 2. Определите наиболее вероятную скорость молекул газа, плотность которого при давлении р = 40 кПа составляет r = 0,35 кг/м3.
Решение:
Воспользуемся формулой  .
.
Из уравнения состояния выражаем плотность газа:
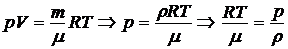 ,
,
Тогда, подставляя, получим
 = 478 м/с.
= 478 м/с.
Задача 3. Плотность газа увеличили в k 1 = 3 раза, а температуру уменьшили в k 2 = 4 раза. Как изменилось число столкновений молекул в единицу времени?
Решение:
Среднее число столкновений молекул в единицу времени находится по формуле
 ,
,
где  — средняя скорость движения молекул, d — эффективный диаметр молекул, n — концентрация молекул.
— средняя скорость движения молекул, d — эффективный диаметр молекул, n — концентрация молекул.
Формула для вычисления средней скорости:
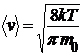 ,
,
связь концентрации молекул с плотностью газа определяется формулой:

Эффективный диаметр молекул d, т.е. минимальное расстояние, на которое сближаются при столкновении центры молекул, зависит от скорости сталкивающихся молекул, т.е. от температуры газа (несколько увеличивается при понижении температуры). Но при решении данной задачи это изменение величины d учитывать не будем.
Подставляем записанные выражения в первую формулу:
 ,
,
тогда после изменения давления и температуры
 ,
,
т. е. длина свободного пробега при этом увеличится в
 =
=  = 1,5 раза.
= 1,5 раза.
Следует отметить, что в формулы входит именно термодинамическая температура.
Задача 4. Коэффициенты диффузии и внутреннего трения водорода при некоторых условиях равны соответственно D=1,42 см2/сек и η=8,5·10-6 Н·сек/м2. Найти число молекул водорода в 1 м3 при этих условиях.
Решение:
Для решения задачи воспользуемся формулами расчета коэффициента внутреннего трения (динамической вязкости) и коэффициента диффузии:
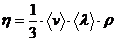 (1)
(1)
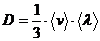 (2)
(2)
Объединив формулы (1) и (2), получим
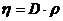
Откуда следует, что плотность водорода равна
 (3)
(3)
С другой стороны плотность газа может быть найдена по формуле
 (4)
(4)
Объединив формулы (3) и (4), получим выражение для массы водорода
 (5)
(5)
Известно, что число молекул  можно рассчитать по формуле
можно рассчитать по формуле
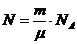 , (6)
, (6)
где m = 2·10-3 кг/моль — молярная масса водорода,
N A = 6,02·1023 1/моль — число Авогадро.
Из формул (5) и (6) находим концентрацию молекул газа

Подставив численные значения, получим:
Ответ: n = 1,8·1025 м-3
Задача 5. Работа расширения некоторого двухатомного идеального газа составляет А = 2 кДж. Определите количество подведенной к газу теплоты, если процесс протекал: 1) изотермически; 2) изобарно;
Решение:
Согласно первому началу термодинамики подведенное к газу количество теплоты Q расходуется им на изменение внутренней энергии и на совершение работы расширения:
Q= D U+A.
1) В случае T= const,  = 0, D U
= 0, D U  = 0 и Q 1 = A = 2 кДж.
= 0 и Q 1 = A = 2 кДж.
2) При p= constполучаем
 ,
,
где D T — изменение температуры при изобарном увеличении объема на D V. Из уравнений начального и конечного состояний получаем:
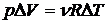 ,
,
т. е.
 .
.
Тогда
 =
=  = 7 кДж.
= 7 кДж.
где i = 5, т.к. газ двухатомный.
Задача 6. Баллон содержит  кислорода и
кислорода и  аргона. Давление смеси газов
аргона. Давление смеси газов  , температура
, температура  . Принимая данные газы за идеальные, определить объем V баллона.
. Принимая данные газы за идеальные, определить объем V баллона.
Решение:
По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси.
По уравнению Менделеева — Клапейрона парциальные давления  кислорода и
кислорода и 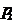 аргона выражаются формулами:
аргона выражаются формулами:


Следовательно, по закону Дальтона давление смеси двух газов:
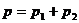
или

откуда объем баллона

Произведем вычисления, учитывая, что  –—молярная
–—молярная
масса кислорода,  – молярная масса аргона
– молярная масса аргона
 .
.
Ответ:  .
.
Задача 7. Гелий массой  совершает цикл, изображенный на рисунке. Найти работу А, совершаемую газом за один цикл, количество теплоты, принятое от нагревателя
совершает цикл, изображенный на рисунке. Найти работу А, совершаемую газом за один цикл, количество теплоты, принятое от нагревателя  и переданное холодильнику
и переданное холодильнику  за цикл, КПД цикла, если
за цикл, КПД цикла, если  ,
,  ,
,  ,
,  .
.

Решение:
Определим количество вещества
 ,
,
где m = 2·10-3 кг/моль — молярная масса гелия.
Рассмотрим каждый участок цикла отдельно.
(1-2): запишем первый закон термодинамики
 .
.
На данном участке давление пропорционально объему:
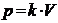 ,
,
где  .
.
Работа  определяется, исходя из изотермического смысла работы газа в координатной плоскости (р, V):
определяется, исходя из изотермического смысла работы газа в координатной плоскости (р, V):
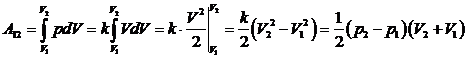 .
.
 .
.
 ,
,
где 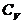 — молярная теплоемкость при постоянном объеме.
— молярная теплоемкость при постоянном объеме.
Воспользуемся уравнением состояния идеального газа
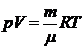 ,
,
тогда
 ,
,
где для одноатомного гелия число степеней свободы 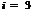 , тогда
, тогда
 .
.
Так как  , то газ на этом участке получает от нагревателя теплоту.
, то газ на этом участке получает от нагревателя теплоту.
(2-3): Так как  , то
, то  и первый закон термодинамики принимает вид
и первый закон термодинамики принимает вид
 ,
,
где  ;
;
 .
.
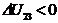 , значит внутренняя энергия уменьшается.
, значит внутренняя энергия уменьшается.
 . Так как
. Так как  , то газ на этом участке отдает теплоту холодильнику.
, то газ на этом участке отдает теплоту холодильнику.
(3-1):
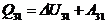 ,
,  (газ совершает «отрицательную» работу; его сжимают).
(газ совершает «отрицательную» работу; его сжимают).

где  — молярная теплоемкость при постоянном давлении.
— молярная теплоемкость при постоянном давлении.
Так как 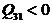 , то газ на участке 3-1 также отдает теплоту холодильнику.
, то газ на участке 3-1 также отдает теплоту холодильнику.
Итого:  ,
,
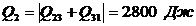 .
.
 или
или 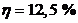 .
.

Замечание: используя геометрический смысл работы в координатной плоскости (р, V) видно, что работу за цикл можно рассчитать, определив площадь фигуры цикла (в нашем случае – это площадь треугольника).
Ответ:  ,
,  ,
,  ,
,  .
.
Задача 8. Двигатель работает как машина Карно и за цикл получает от нагревателя 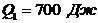 теплоты. Температура нагревателя
теплоты. Температура нагревателя  , температура холодильника
, температура холодильника  . Найти:
. Найти:
1. Совершаемую за цикл работу;
2. Количество теплоты, отдаваемое холодильнику.
Решение:
Запишем формулу для КПД тепловой машины:
 ,
,
т. к. двигатель работает по циклу Карно, то
 .
.
Совершаемая газом работа за цикл
 .
.
Тогда  ,
,  ,
,
где  ,
,  .
.

Количество теплоты:  (Дж).
(Дж).
Ответ:  Дж.
Дж.
Задача 9. Один моль идеального двухатомного газа, находящегося в закрытом сосуде, охладили с  до
до  . На сколько и как изменилась энтропия газа?
. На сколько и как изменилась энтропия газа?
Решение:
Запишем второй закон термодинамики в формулировке Клаузиуса
 ,
,
где dS — приращение энтропии.
По первому закону термодинамики, записанному для элементарного теплового процесса
 или
или  .
.
Элементарное приращение внутренней энергии газа
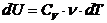 ,
,
тогда
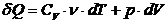 .
.
Для идеального газа молярная теплоемкость при постоянном объеме

где i — число степеней свободы.
Из уравнения состояния идеального газа следует, что
 .
.
Тогда
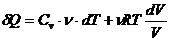 .
.
После деления на абсолютную температуру Т, имеем
 ,
,
 .
.
Проинтегрируем полученное дифференциальное уравнение, расставляя пределы интегрирования

 ,
,
 .
.
Итого, приращение энтропии  .
.
Замечание: Используя полученное выражение для  и уравнение Менделеева-Клапейрона для начального и конечного состояний идеального газа, легко получить
и уравнение Менделеева-Клапейрона для начального и конечного состояний идеального газа, легко получить
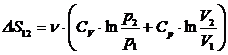 ,
,
где  — молярная теплоемкость идеального газа при постоянном давлении;
— молярная теплоемкость идеального газа при постоянном давлении;
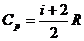 .
.
Рассчитаем изменение энтропии газа, учитывая, что при закрытом сосуде
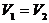 .
.
 ,
,  ,
, 
(для двухатомного газа число степеней свободы  ).
).
 .
.
Ответ: энтропия газа уменьшилась на  .
.
Задача 10. Во сколько раз следует изотермически увеличить объем идеального газа в количестве 3 моль, чтобы его энтропия увеличилась на
25 Дж/К?
Решение:
Для обратимого процесса
 ,
,
где  .
.
Так как процесс изотермический, то для идеального газа  , а элементарная работа равна
, а элементарная работа равна
 .
.
Изменение энтропии  для изотермического процесса будет равно
для изотермического процесса будет равно
 .
.
Из последнего соотношения находим
 .
.
Показатель экспоненты – величина безразмерная.
Вычисления:  .
.
Ответ: 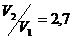 .
.
 2018-01-08
2018-01-08 3116
3116
