Задача 10.
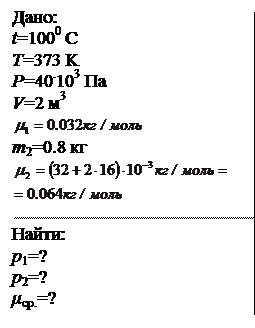
В сосуде при температуре 1000С и давлении 40 кПа находится 2 м3 смеси кислорода и сернистого газа (SO2). Масса сернистого газа 0.8 кг. Определить парциальное давление компонентов смеси и среднюю молярную массу. Относительная атомная масса серы равна 32.
Решение
По закону Дальтона давление смеси газов равно сумме парциальных давлений компонент смеси:
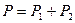 . (1)
. (1)
Для парциальных давлений кислорода и сернистого газа запишем уравнение Менделеева-Клапейрона:
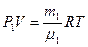 , (2)
, (2)
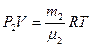 . (3)
. (3)
Сложим почленно (2) и (3) и учтём (1):
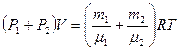 ,
,
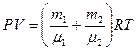 . (4)
. (4)
Запишем уравнение состояния для смеси газов, введя среднюю молярную массу:
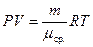 , (5)
, (5)
где 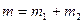 – полная масса смеси.
– полная масса смеси.
Сравнив (4) и (5), получим выражение для средней молярной масс смеси: 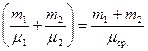 , или
, или
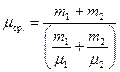 . (6)
. (6)
Из (3) получаем давление P 2: 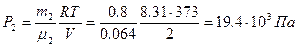 . Из (1) – давление P 1:
. Из (1) – давление P 1: 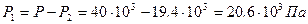 . Уравнение (2) позволит найти массу m 1:
. Уравнение (2) позволит найти массу m 1: 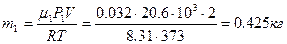 . Теперь по (6) можно рассчитать среднюю молярную массу
. Теперь по (6) можно рассчитать среднюю молярную массу 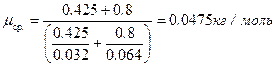 .
.
Ответ: 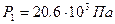 ,
, 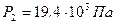 ,
, 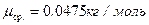 .
.
Задача 11.
Найти число молекул хлора в одном кубическом миллиметре при t = 500°С и давлении 105 Па, компоненты скорости которых заключены в следующих интервалах: vх = (200 ÷ 205) м/с; vу =(100 ÷ 110) м/с; vz = (100 ÷ 105) м/с. Относительная атомная масса хлора 35.45.
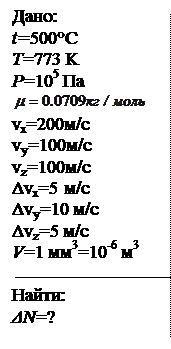 Решение
Решение
Воспользуемся законом распределения молекул по компонентам скоростей: 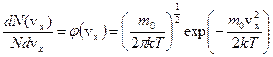 , откуда получим вероятность того, что проекция скорости на ось OX лежит в интервале от vх до vх + Δvх равна:
, откуда получим вероятность того, что проекция скорости на ось OX лежит в интервале от vх до vх + Δvх равна:
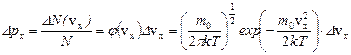 . Аналогично, для проекций скорости vу и vz:
. Аналогично, для проекций скорости vу и vz:
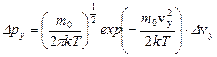 ;
; 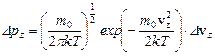 .
.
Здесь было использовано то, что Δvx<<vx, Δvy<<vy, Δvz<<vz.
По закону умножения вероятностей вероятность того, что молекула одновременно имеет все три проекции скоростей в указанных интервалах, равна произведению вероятностей:
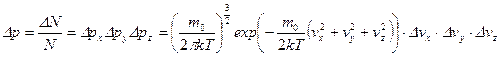 , откуда искомое число молекул
, откуда искомое число молекул 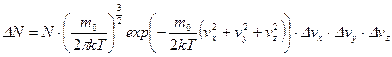 . Здесь N – полное число молекул в объёме V:
. Здесь N – полное число молекул в объёме V: 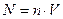 , n – концентрация молекул. Она может быть найдена из уравнения Менделеева-Клапейрона
, n – концентрация молекул. Она может быть найдена из уравнения Менделеева-Клапейрона 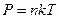 . Тогда
. Тогда
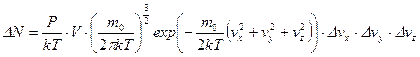 .
.
В последнем выражении остаётся неизвестной только масса одной молекулы; её найдём из закона Авогадро: 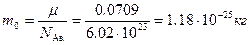 . Теперь можно найти искомую величину:
. Теперь можно найти искомую величину:
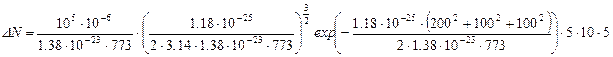 ,
, 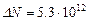 .
.
Ответ: 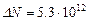 .
.
211. В сосуде находятся 14 г азота и 9 г водорода при температуре 100С и давлении 1 МПа. Найти среднюю молярную массу смеси и объем сосуда.
212. Определить плотность смеси газов, состоящей из 5 молей азота и 10 молей кислорода. Смесь находится в баллоне при 170С и давлении 1.5 МПа.
213. Давление и плотность некоторого газа при 170С равны 750 мм рт.ст. и 8.2.10-4 г/см3 соответственно. Что это за газ?
214. Под каким давлением находится в баллоне водород, если емкость баллона 10 литров, а кинетическая энергия поступательного движения всех молекул водорода равна 7.5.103 Дж?
215. Под каким давлением находится газ, если средняя квадратичная скорость его молекул 550 м/с, а плотность 9.10-4 г/см3?
216. Чему равна кинетическая энергия поступательного движения всех молекул, содержащихся в одном моле и в 1 кг гелия при температуре 1000 К?
217. Температура на улице –130С, в помещении 220С. На сколько изменится давление в газовом баллоне, если баллон внести в помещение? В помещении манометр на баллоне показывал 1.5 МПа.
218. Сколько частиц воздуха находится в комнате площадью 20 м2 и высотой 3 м при температуре 170С и давлении 752 мм рт.ст.?
219. Баллон вместимостью 25 л, содержащий воздух под давлением 3.105 Па, соединяют с другим баллоном вместимостью 50 л, из которого воздух откачан. Найти установившееся давление воздуха в баллонах, если температура оставалась постоянной.
220. После соединения двух баллонов вместимостью 2 и 3 л давление смеси газов в них стало 2.4.105 Па. Определить давление газов в баллонах до их соединения, если в первом баллоне оно было на 50 кПа больше, чем во втором. Процесс изотермический.
221. Одноатомный газ массой 1.5 кг находится под давлением 5 атм и имеет плотность 6 кг/м3. Найти энергию теплового движения молекул газа при этих условиях.
222. Какое число молекул аммиака занимают объем 50 мл при давлении 0.1 атм и температуре 300 К? Какой энергией теплового движения обладают эти молекулы?
223. В первом сосуде объемом 3 л находится газ под давление 202 кПа, а во втором объемом 4 л – 101 кПа. Под каким давлением будет находиться газ, если эти сосуды соединить? Температура в сосудах одинакова и постоянна.
224. В баллоне объемом 10 л находится гелий под давлением 1 МПа при температуре 300 К. После того как из баллона было взято 10 г гелия, температура в баллоне понизилась до 290 К. Определить давление гелия, оставшегося в баллоне.
225. В сосуде объемом 2 л находится 6 г углекислого газа и 4 г закиси азота (N2O) при температуре 400 К. Найти давление смеси в сосуде.
226. Смесь гелия и аргона находится при температуре 1.2 Кк. Определить среднюю квадратичную скорость и среднюю кинетическую энергию атомов аргона и гелия. Молярная масса аргона 0.04 кг/моль.
227. Какой объем занимает смесь 1 кг азота и 1 кг гелия при нормальных условиях?
228. В баллоне вместимостью 15 л находится смесь 10 г водорода, 54 г водяного пара и 60 г окиси углерода. Температура смеси 300 К. Определить давление.
229. Смесь азота с массовой долей 87.5 % и водорода с массовой долей 12.5 % находится в сосуде объемом 20 л при температуре 560 К. Определить давление смеси, если масса смеси 8 г.
230. Определить суммарную кинетическую энергию поступательного движения всех молекул газа, находящегося в сосуде объемом 3 л под давлением 540 кПа.
231. Определить среднюю квадратичную скорость молекул газа, заключенного в сосуде объемом 2 л под давлением 200 кПа. Масса газа 0.3 г.
232. Водород находится при температуре 300 К. Найти среднюю кинетическую энергию вращательного движения одной молекулы, суммарную кинетическую энергию вращательного движения всех молекул этого газа и полную кинетическую энергию всех молекул. Количество вещества 0.5 моль.
233. В баллоне объемом 25 л находится водород при температуре 290 К. После того как часть газа израсходовали, давление в баллоне понизилось на 0.4 МПа. Определить массу израсходованного газа. Температура постоянна.
234. В сосуде объемом 1.5 л находится смесь азота и водорода при температуре 300 К и давлении 200 кПа. Определить массу смеси и ее компонентов, если массовая доля азота в смеси равна 70%.
235. В сосуде находится смесь кислорода и водорода. Масса смеси 3.6 г. Массовая доля кислорода 60%. Определить количество каждого вещества и всей смеси.
236. В колбе вместимостью 100 мл находится некоторый газ при температуре 300 К. Вследствие утечки из колбы вышло 1020 молекул. На сколько понизилось давление газа в колбе?
237. В баллоне емкостью 2 м3 находится смесь азота и окиси азота (NO). Определить массу окиси азота, если масса смеси равна 14 кг, температура смеси 300 К и давление 600 кПа.
238. Определить плотность смеси, состоящей из 4 г водорода 32 г кислорода при температуре 70С и давлении 93 кПа.
239. При какой температуре энергия теплового движения атомов гелия будет достаточна для того, чтобы преодолеть земное притяжение и навсегда покинуть атмосферу?
240. Чему равна энергия теплового движения 20 г кислорода при температуре 100С? Какая часть этой энергии приходится на долю поступательного движения и какая часть - на долю вращательного?
211. Два стрелка одновременно и независимо стреляют в одну цель. Вероятности попадания в цель первым и вторым стрелками равны соответственно 0.8 и 0.7. Найти вероятность того, что цель поразит только первый стрелок.
212. Два стрелка одновременно и независимо стреляют в одну цель. Вероятности попадания в цель первым и вторым стрелками равны соответственно 0.8 и 0.7. Найти вероятность того, что цель останется непораженной.
213. В сосуде находится N молекул. Найти вероятность p того, что в процессе хаотического движения все молекулы соберутся в одной половине сосуда. Вычислить p для N= 2; 10; N=NА.
214. Величина x может принимать только два значения: x 1 и x 2, причем вероятность первого равна p 1=0.3. Найти среднее значение: а) < x >; б) < x 3> третьей степени величины x.
215. Распределение вероятностей значений некоторой величины x описывается функцией f=Ax (a– x) при 0≤ x ≤ a. Вне этого интервала f =0. Здесь A и a – постоянные (a известно, А – неизвестно). Найти: а) наиболее вероятное значение x и соответствующее значение функции f; б) средние значения x и x 2 в интервале (0; а).
216. Какая температура соответствует средней квадратичной скорости молекул углекислого газа, равной 720 км/ч?
217. Определить среднюю квадратичную скорость капельки воды радиусом 10-6 см, взвешенной в воздухе при температуре 170С.
218. Найти среднюю квадратичную скорость молекул воздуха при температуре 170С, считая воздух однородным газом с молярной массой 0.029 кг/моль.
219. Найти концентрацию молекул водорода при давлении 266.6 Па, если средняя квадратичная скорость его молекул 2400 м/с.
220. При какой температуре средняя квадратичная скорость молекул азота больше их наиболее вероятной скорости на 50 м/с?
221. Какой процент молекул обладает скоростями, отличающимися от наиболее вероятной не более чем на 1%?
222. Какой процент молекул обладает скоростями, отличающимися от средней квадратичной не более чем на 1%?
223. Найти число молекул азота в объеме 1 см3 при н.у., скорости которых лежат в интервале 99÷101 м/с.
224. Найти число молекул азота в объеме 1 см3 при н.у., скорости которых лежат в интервале 499÷501 м/с.
225. При какой температуре число молекул азота, скорости которых лежат в интервале 299÷301 м/с, равно числу молекул со скоростями в интервале 599÷601 м/с?
226. Найти для газообразного азота при температуре 300 К отношение числа молекул с компонентами скорости вдоль оси OX в интервале 300 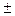 0.31 м/с к числу молекул с компонентами скорости вдоль той же оси в интервале 500
0.31 м/с к числу молекул с компонентами скорости вдоль той же оси в интервале 500 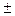 0.51 м/с.
0.51 м/с.
227. Азот находится в равновесном состоянии при 421 К. Найти наиболее вероятную скорость молекул. Определить относительное число молекул, скорости которых заключены в пределах: а) от 499.9 до 500.1 м/с; б) от 249.9 до 250.1 м/с; в) от 999.9 до 1001.1 м/с.
228. Найти температуру газообразного азота, при которой скоростям молекул 300 м/с и 600 м/с соответствуют одинаковые значения функции распределения.
229. Вычислить среднюю проекцию скорости <vx> и среднее значение модуля проекции <|vx|>, если масса каждой молекулы m 0 и температура газа Т.
230. Вычислить наиболее вероятную, среднюю и среднюю квадратичную скорости молекул газа, у которого при нормальном атмосферном давлении плотность 1 г/л.
231. Определить температуру водорода, для которой средняя квадратичная скорость молекул больше их наиболее вероятной скорости на 400 м/с.
232. Найти число молекул хлора в одном кубическом миллиметре при t =500°С и давлении 105 Па, компоненты скорости которых заключены в следующих интервалах: vх=(200÷205) м/с; vу=(100÷110) м/с; vz=(100÷105) м/с. Относительная атомная масса хлора 35.45.
233. Смесь водорода и гелия находится при 300 К. При какой скорости молекул значения функции f (v) будут одинаковыми для обоих газов?
234. Идеальный газ состоит из молекул, масса каждой из которых равна т. При какой температуре этого газа число молекул со скоростями в заданном малом интервале (v, v+dv) будет максимально? Найти наиболее вероятную скорость молекул, соответствующую такой температуре.
235. Газ состоит из молекул массой т и находится при температуре Т. Найти с помощью функции распределения наиболее вероятную кинетическую энергию E. Соответствует ли E вер. наиболее вероятной скорости?
236. Определить температуру кислорода, для которой функция распределения молекул по скоростям будет иметь максимум при скорости 420 м/с.
237. Определить скорость молекул, соответствующую максимуму функции распределения при 100°С для водорода, гелия и азота.
238. Какая часть молекул воздуха при температуре 17°С обладает скоростями, отличающимися не больше чем на 0.50 м/с от скорости, равной vвер?
239. Найти число молекул гелия в 1 см3, скорости которых лежат в интервале от 2.39.103 м/с до 2.61.103 м/с. Температура гелия 690°С, его плотность 2.16.10-4 кг/м3.
240. В баллоне, объем которого 10.5 л, находится водород. При температуре 0°С давление водорода 750 мм рт. ст. Найти число молекул водорода, скорости которых лежат в интервале от 1.19.103 м/с до 1.21.103 м/с.
241. Дана группа частиц, распределение по скоростям которых задано табл. 2.
Таблица 2.
| N i | |||||
| vi, см/с |
Здесь N i – число частиц, имеющих скорость vi. Каковы характерные скорости этой системы: среднеквадратичная, средняя арифметическая, наиболее вероятная?
242. Давление воздуха на уровне моря 750 мм рт.ст., а на вершине горы 590 мм рт.ст. Какова высота горы, если температура воздуха равна 50С?
243. Предположим, что внутри вертикальной трубы высотой 100 м находится воздух при температуре 500 К; снаружи труба окружена воздухом при температуре 250 К. Труба сверху открыта, а внизу отделена от наружного воздуха заслонкой площадью 300 см2. Какая сила действует на заслонку, если давление воздуха у верхнего конца трубы равно 740 мм рт.ст.?
244. Каким должно быть давление воздуха на дне скважины глубиной 8 км, если считать, что температура по всей высоте постоянна и равна 300 К, а давление воздуха у поверхности земли равно 1 атм?
245. Сколько весит 1 м3 воздуха: 1) у поверхности Земли; 2) на высоте 4 км? Температуру считать постоянной и равной 00С, давление у поверхности 100 кПа.
246. На какой высоте плотность газа составляет 50% от плотности его на уровне моря? Температуру считать постоянной и равной 00С. Задачу решить для: 1) воздуха; 2) водорода.
247. Вблизи поверхности Земли отношение концентраций кислорода и азота в воздухе равно 0.268. Полагая температуру атмосферы не зависящей от высоты и равной 00С, определить это отношение на высоте 10 км.
248. На какой высоте плотность газа составляет 75% от плотности его на уровне моря? Температуру считать постоянной и равной 00С. Задачу решить для: 1) воздуха; 2) углекислого газа.
249. В баллоне, объем которого 10.5 л, находится водород. При температуре 0°С давление водорода 750 мм рт. ст. Найти число молекул водорода, скорости которых лежат в интервале от 1.19.103 м/с до 1.21.103 м/с при 3000 К.
250. При каком значении скорости пересекаются кривые распределения Максвелла для температур T и 2 T?
251. Какая часть молекул сернистого ангидрида (SО2) при температуре 200°С обладает скоростями в пределах 210÷220 м/с м/с?
252. Какая часть молекул водорода при температуре 500°С обладает скоростями в пределах 420÷430 м/с?
253. Чистый газообразный кислород находится при температуре 300 Kи давлении 2 атм. Найти число молекул в объеме 1 мм3, компоненты скорости которых лежат в следующих пределах: vх – от 200 до 202 м/с, vу – от 450 до 455 м/с, vz – от 299 до 300 м/с.
254. Азот находится при температуре 0 °С. Чему равно относительное число молекул, скорость которых лежит в интервале от 250 до 260 м/с?
255. Найти число молекул хлора в 1 мм3 при температуре 500°С и давлении 105 Па, компоненты скорости которых заключены в следующих интервалах: vх=(200÷205) м/с, vу=(100÷110) м/с, vz = (100÷105) м/с. Относительная атомная масса хлора равна 35.45.
256. Чему равно число атомов гелия со скоростями от 1000 до 1010 м/с, содержащихся в шарообразном баллоне диаметром 16 м при 10°С и давлении 0.9 ат?
257. Вычислить средние скорости для водорода, неона и кислорода при 500°С.
258. Зная функцию распределения молекул по скоростям в некотором молекулярном пучке: 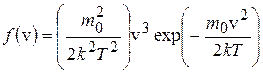 , найти выражение для наиболее вероятной скорости.
, найти выражение для наиболее вероятной скорости.
259. Используя функцию распределения молекул по энергиям, определить наиболее вероятное значение энергии.
260. Найти относительное число молекул идеального газа, кинетические энергии которых отличаются от наиболее вероятного значения энергии не более чем на 1%.
261. Потенциальная энергия молекул газа в некотором центральном поле зависит от расстояния r до центра поля как U (r)= ar 2, где а – положительная постоянная. Температура газа равна Т, концентрация молекул в центре поля n 0. Найти: а) число молекул, находящихся в интервале расстояний (r, r + dr); б) наиболее вероятное расстояние молекул от центра поля.
262. Два стрелка одновременно и независимо стреляют в одну цель. Найти вероятность поражения цели, если вероятности попадания в цель первым и вторым стрелками равны соответственно 0.8 и 0.7. Цель считается пораженной, если в нее попадает хотя бы один стрелок.
263. Функция распределения вероятностей значений некоторой величины x имеет вид f=Ax при 0≤ x ≤ a. Вне этого интервала f =0. Здесь A и a – постоянные (a известно, А – неизвестно). Найти А, вычислить значение функции при x = a, найти средние значения x и x 2 в интервале (0, а).
264. Найти отношение средних квадратичных скоростей молекул гелия и азота при одинаковых температурах.
265. Найти среднюю арифметическую, среднюю квадратичную и наиболее вероятную скорости молекул газа, плотность которого при давлении 300 мм рт.ст. равна 0.3 г/л.
266. Во сколько раз число молекул ΔN1, скорости которых лежат в интервале от vкв до vкв+Δv, меньше числа молекул ΔN2, скорости которых лежат в интервале от vв+Δv? Интервал Δv считать достаточно малым.
267. Определить долю молекул идеального газа, энергии которых отличаются от средней энергии поступательного движения молекул при той же температуре не более, чем на 1%.
268. Найти вероятность того, что при температуре 300 К молекулы азота имеют компоненты скорости вдоль осей OX, OY, OZ соответственно в интервале 300 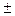 0.30 м/с, 400
0.30 м/с, 400 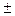 0.40 м/с; 500
0.40 м/с; 500 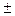 0.50 м/с.
0.50 м/с.
269. Найти силу, действующую на частицу со стороны однородного поля, если концентрация этих частиц на двух уровнях, отстоящих друг от друга на расстояние 3 см (вдоль поля) отличаются в 2 раза. Температура системы 280 К.
270. Метеорологический шар с водородом перед запуском имеет объем 0.04 м3. Определить объем шара на высоте 3000 м над местом запуска. Среднюю температуру воздуха на высоте считать равной 70С.
 2015-05-13
2015-05-13 17834
17834








