Вопрос 1: Основные химические понятия: атом, молекула, химический элемент, относительные атомные и молекулярные массы.
Химия – наука о веществах, их составе, строении, свойствах, превращениях и явлениях, сопровождающих эти превращения. В середине VIII века химия стала наукой благодаря М.В. Ломоносову.
Атомно-молекулярное учение (АМУ)
АМУ – свод понятий и законов химии. Стало формироваться в VIII века, развивается до сих пор.
Атом – мельчайшая част хим.эл., неделимая хим путем. Понятие было предложено в Др. Греции Демокритом и Левкипом.
Молекула – мельчайшая часть в-ва, сохраняющая его хим св-ва. Молекулы в-в различаются по составу, строению, массе, свойствам.
Простое вещество – в-во из атомов одного элемента(N2, Cl2, O2). Обладает свойством совокупности атомов.
Сложное вещество – молекулы этого вещества состоят из атомов разного вида (HCL,H2O,СО2).
Химический элемент – вид атомов с зарядом атома (совокупность атомов одного вида).
Простое в-во и хим эл. – разноуровневые понятия. Простое в-в – это форма существования хим элемента.
Аллторопия – явление сущ-я хим.эл. в виде нескольких простых в-в – аллотропных модификаций. Они могут отличаться кол-вом атомов в молекуле или строением кристаллической решетки (O2 и O3; алмаз и графит).
Изотопы – атомы одного эл., имеющие одинаковый заряд ядра, но разные атомные массы. Водород (протий, дейтерий тритий).
Относительные атомная и молекулярная массы
Массы атомов имеют очень малое значение, поэтому для определения атомных масс удобно пользоваться спец единицами. Первый такую единицу предложил в 1808г. Джон Дальтон (водородная единица (сравнивалась с массой Н)).
Позднее шведский ученый Берцелиус предложил кислородную единицу. Она просуществовала до 1961 г. Затем в химии и физике за основу была принята 1/12 массы углерода (С) – атомная единица массы (а. е. м.).
Относительная атомная масса – это масса атома, измеренная по отношению к атомной единице масс (а.е.м.). 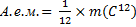
ОАМ показывает во сколько раз масса данного атома больше а.е.м. [Ar]
A (Fe)=56 а.е.м.; Ar (Fe)=56 (величина безразмерная).
Относительная молекулярная масса – это масса молекулы, измеренная по отношению к а.е.м. [Mr]
Mr(H2O) = 18
Для определения относительных атомных и молекулярных масс используются методы:
· По закону Авогадро (по следствию из него) (см. вопрос 3)
o 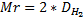
o По пропорции:
1л (н.у.) -- 5г
22,4л -- х
Х = M = Mr
· Уравнение Менделеева– Клапейрона
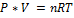
где n – число молей газа; P – давление газа; V – объем газа; T – температура газа; R – газовая постоянная.
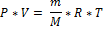
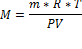
M=Mr
o Если Р в мм, то V в мл, а R = 62400 мм.рт.ст/моль*К
o Если Р в Па, то V в м3, а R=8.31 Дж/моль*К
o Если Р в атмосферах, то V в л, а R = 0,0082 л*атмосфер/моль*К
1м3=1000л=1000000мл
· Для металлов правило Дюлонга и Пти.
Теплоемкость – отношение кол-ва теплоты полученной в-вом при нагревании или отданной при охлаждении к изменению температуры, которая при этом происходит. Учитывая, что для большинства металлов теплоемкость остается постоянной величиной, Дюлонг и Пти предложили правило: произведение атомной массы металла на его удельную теплоемкость, есть величина постоянная и равная 26 кДж/моль К.
Исходя из этой величины легко можно рассчитывать атомные массы металлов, расчет ведется в 2 этапа:
1. Определяют приближенное значения атомной массы металла, затем эквивалент, проводят деление приближенного значения атомной массы на эквивалент и получают валентность. 2. Полученное значение округляем для целого и перемножаем значение эквивалента и валентности, получаем точную атомную массу.
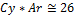
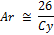
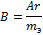
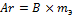
Моль – такое кол-во вещества, которое содержит столько же структурных единиц (молекул/атомов), сколько атомов содержится в 12 г изотопа С12: 6,02*1023 атомов (число Авогадро – число частиц в 1 моле вещества).
1 моль О2 = 6,02*1023 молекул
1 моль О = 6,02*1023 атомов.
Молярная масса – это масса вещества, взятого количеством один моль. [M] = г/моль
M = Mr 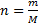
 2018-01-21
2018-01-21 2240
2240