Скорость химической реакции есть изменение концентрации реагирующих веществ в единицу времени.
Средняя скорость реакции в интервале времени записывается следующим образом:
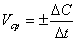 ,
,
Вычисленные средние скорости занесем в таблицу (табл. 1). В различных интервалах времени средняя скорость химической реакции имеет разные значения; истинная (мгновенная) скорость реакции определяется как производная от концентрации по времени:
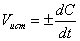
Молекулярность реакции - число частиц реагентов, взаимодействующих друг с другом в одной элементарной (простой) реакции и превращающихся в продукты. Так, для реакций в растворах молекулярность реакции не учитывает число молекул растворителя, образующих сольватную оболочку или мол. комплексы с реагентами, так как эти молекулы не входят в состав продуктов реакции. В реакциях замещения и элиминирования органических соединений, протекающих часто в несколько стадий, Молекулярность реакции оценивается как число молекул, претерпевающих химическое превращение в лимитирующей стадии. Соответственно числу реагирующих частиц различают мономолекулярные реакции, бимолекулярные реакции и тримолекулярные реакции, отличающиеся кинетическими закономерностями и механизмом. Как правило, молекулярность простой реакции совпадает с порядком реакции, однако бывают и несовпадения. Например, рекомбинации атомов в газовой фазе протекают через тройные столкновения типа 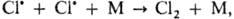 где М-третья частица. Суммарный порядок таких реакций-третий (скорость u = = k [М][Сl]2, где k -константа скорости), но молекулярность равна 2, так как в химическом взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом химические превращения.
где М-третья частица. Суммарный порядок таких реакций-третий (скорость u = = k [М][Сl]2, где k -константа скорости), но молекулярность равна 2, так как в химическом взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом химические превращения.
Уравне́ние Бо́льцмана (кинети́ческое уравнение Больцмана) — уравнение, названное по имени Людвига Больцмана, который его впервые рассмотрел, и описывающее статистическое распределение частиц в газе или жидкости. Является одним из самых важных уравнений физической кинетики (области статистической физики, которая описывает системы, далёкие от термодинамического равновесия, например, в присутствии градиентов температур и электрического поля). Уравнение Больцмана используется для изучения переноса тепла и электрического заряда в жидкостях и газах, и из него выводятся транспортные свойства, такие как электропроводность, эффект Холла, вязкость и теплопроводность. Уравнение применимо для разреженных систем, где время взаимодействия между частицами мало (гипотеза молекулярного хаоса).
ПОРЯДОК РЕАКЦИИ по данному веществу, показатель степени при концентрации этого вещества в кинетическом уравнении химической реакции. Суммарный порядок реакции слагается из порядков реакции по всем веществам, концентрации которых входят в кинетическое уравнение.
Период полупревращения -это время, необходимое для того, чтобы исходная концентрация реагента уменьшилась вдвое. Измерение периода полупревращения приносит большую пользу при исследованиях порядка реакции.
Вопрос 7
скорость реакции при увелич концентрации- Число столкновений растет с увеличением числа реагирующих частиц в единице объема, т.е. с увеличением концентрации веществ. Это утверждение нашло отражение в законе действующих масс
 2018-01-21
2018-01-21 5151
5151
