Закон сохранения массы веществ
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов
реакции.
*Атомно-молекулярное учение этот закон объясняет следующим образом: в результатехимических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е.химическое превращение- это процесс разрыва одних связей между атомами и образование
других, в результате чего из молекул исходных веществ получаются молекулы продуктовреакции). Поскольку число атомов до и после реакции остается неизменным, то их общая массатакже изменяться не должна. Под массой понимали величину, характеризующую количество
материи.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций ипо ним производить расчеты. Он является основой количественного химического анализа.
Все индивидуальные химические вещества имеют постоянный качественный и
количественный состав и определенное химическое строение, независимо от способаполучения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы
соединяются друг с другом в определенных массовых соотношениях.
Закон Авогадро ди Кваренья (1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление ит.д.) содержится одинаковое число молекул. (Закон справедлив только для газообразныхвеществ.)
Следствия.
1. Одно и то же число молекул различных газов при одинаковых условиях занимает
одинаковые объемы.
2. При нормальных условиях (0°C = 273°К, 1 атм = 101,3 кПа) 1 моль любого газа занимает
объем 22,4 л.__
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB +... =...
V = k • [A]a • [B]b •...
Закон сохранения энергии: энергия изолированной системы (не обменивающейся с окружающей средой ни веществом, ни энергией) остается постоянной, возможны лишь переходы ее из одного вида в другой.
Закон сохранения электрического заряда: алгебраическая сумма электрических зарядов в изолированной системе сохраняется.
2. Основной закон химии как частный случай общего закона материального мира. Понятия: материя, вещество, поле, движение - и их количественные характеристики и взаимосвязь. Математические выражения законов сохранения массы и энергии.
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB +... =...
V = k • [A]a • [B]b •...
Материя существует в форме вещества и поля. Химия изучает окружающий нас мир объединяемым понятием материи существующей вне и независимо от сознания человека.
вещество - это любая совокупность атомов и молекул
Закон сохранения массы: масса веществ, вступивших в реакцию равна массе веществ, образовавшихся в результате реакции.
* Полностью эквивалентна этой и другая формулировка: в химической реакции число атомов химического элемента сохраняется.Последняя формулировка является основой для написания стехиометрических уравнений реакций.
Закон сохранения энергии: энергия изолированной системы (не обменивающейся с окружающей средой ни веществом, ни энергией) остается постоянной, возможны лишь переходы ее из одного вида в другой.
Q=dU+A
3. Атомно-молекулярное учение: современные положения, краткая история (основоположники).
АТОМНО-МОЛЕКУЛЯРНАЯ ТЕОРИЯ
Атомно-молекулярное учение — учение о строении веществ из атомов и молекул, создано трудами Ломоносова и Дальтона.
*В развитие атомно-молекулярного учения большой вклад внесли М. В. Ломоносов, Дж. Дальтон, А. Лавуазье, Ж. Пруст, А. Авогадро, Й. Берцелиус, Д. И. Менделеев, А. М. Бутлеров.
Состав и свойства химического соединения не зависит от способа и условий его получения.
Все молекулы состоят из атомов. Совокупность или набор атомов одного вида называют химическим элементом.
Атомно-молекулярная теория основные положения:
Все вещества состоят из атомов
Атомы одного химического вещества (химический элемент) обладают одинаковыми свойствами, но отличаются от атомов другого вещества
При взаимодействии атомов образуются молекулы (гомоядерные — простые вещества, гетероядерные — сложные вещества)
При физических явлениях молекулы не изменяются, при химических происходит изменение их состава
Химические реакции заключаются в образовании новых веществ из тех же самых атомов, из которых состояли исходные вещества
4. Основные понятияхимии: атом, молекула, химический элемент, вещество (простое и сложное). Количественные характеристики атома и молекулы: размеры, абсолютная и относительная атомная и молекулярная массы, атомная единица массы (а.е.м.).
Атом — электронейтральная частица, состоящая из положительно заряженного ядра и одного или нескольких электронов.
Молекула — наименьшая частица вещества, обладающая всеми химическими свойствами данного вещества. Для некоторых веществ понятия атома и молекулы совпадают.
Химический элемент — вид атомов, характеризующихся определенным зарядом ядра.
Простым веществом называется вещество, молекулы которого состоят из атомов одного элемента,
Соединениями или сложными веществами называются вещества, молекулы которых состоят из атомов разных элементов
Молекулы различных веществ отличаются друг от друга массой, размерами и химическими свойствами. Все молекулы одного вещества одинаковы.
Молекулы состоят из более мелких частиц - атомов. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ состоят из разных атомов.
Атомы одного элемента отличаются от атомов других элементов зарядом атомного ядра, размером и химическими свойствами. При химических реакциях изменяется состав молекулы. Атомы при химических реакциях не разрушаются.
Международная единица атомных масс равна 1/12 массы изотопа 12C - основного изотопаприродного углерода.
Относительная молекулярная масса (Mr) - безразмерная величина, показывающая, во сколькораз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
5. Расчет количества, молярной массы и молярного объема вещества. Число Авогадро.
Молярная масса вещества М равна отношению массы вещества к его количеству
:M=m/v’
и имеет принятую в химии размерность г/моль. Молярная масса вещества, выраженная в г/моль численно равна его относительной молекулярной массе. Численное равенство означает совпадение числовых значений величин, но не их размерностей.
Аналогично определяется и молярный объем как отношение объема вещества к его количеству:
Vm=V/v’
Молярный объем может иметь размерность м3/моль, л/моль, см3/моль. Молярный объем определен для любого агрегатного состояния вещества и связан с его молярной массой через плотность:
V=M/p
Закон Авогардо: в равных объемах различных газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул.
NA = 6,022 141 29(27)·1023 моль−1
6. Химический элемент, символы элементов. Химическая формула вещества, вид формулы: эмпирическая, молекулярная, графическая. Понятия: валентность (стехиометрическая, связевая, координационная) и степень окисления химического элемента. Примеры.
Химический элемент — вид атомов, характеризующихся определенным зарядом ядра.
Молекулярная (брутто-) формула, показывающая число атомов в молекуле - C6H14,

Графическая
Эмпирическая формуладающая только соотношение элементов C:H = 3:7 — C3H7
Валентность - свойство атомов данного элемента присоединить или замещать в молекуле определенное число атомов других элементов. За единицу валентности принята валентность водорода.
Степенью окисления атома называется величина электростатического заряда атома в простом веществе, в молекуле химического соединения, в ионе
7. Понятия и количественное определение массовой, мольной и объемной долей элемента в молекуле вещества и вещества в смеси. Алгоритм установления эмпирической и молекулярной формул.
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
, 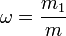
где:
m1 — масса растворённого вещества, г;
m — общая масса раствора, г.
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.
, 
где:
V1 — объём растворённого вещества, л;
V — общий объём раствора, л.
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
,

где:
νi — количество i-го компонента, моль;
n — число компонентов;
Титр раствора — масса растворённого вещества в 1 мл раствора.
, 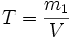
где:
m1 — масса растворённого вещества, г;
V — общий объём раствора, мл;
Эмпирическая формула химического соединения — запись простейшего выражения относительного числа каждого типа атомов в нём; представляет собой линейную запись из символов химических элементов, сопровождающуюся подстрочными индексами, указывающими отношение элементов в соединении[1.
Эмпирическая формула не содержит информации ни о структуре, ни о изомерии, ни о числе атомов в молекуле. Эмпирическая (от греч. εμπειρια — опыт) означает, что определение элементного состава производится при помощи количественного анализа. Например, в случае н-гексана рациональная (линейная) формула, отражающая структуру соединения имеет вид CH3CH2CH2CH2CH2CH3, молекулярная (брутто-) формула, показывающая число атомов в молекуле - C6H14, в то время как эмпирическая формула, дающая только соотношение элементов C:H = 3:7 — C3H7
8. Стехиометрия: предмет изучения, основные законы (перечислить). Закон эквивалентов. Понятия: эквивалент, число и фактор эквивалентности, молярная масса эквивалента вещества.
Раздел химии, изучающий количественные соотношения между реагирующими и образующимися веществами называется стехиометрией. Стехиометрия основывается на законе сохранения массы.
Схема реакции, для которой обеспечено выполнение закона сохранения массы, называется стехиометрическим уравнением реакции. Это выполнение достигается расстановкой коэффициентов, которые называются стехиометрическими коэффициентами.
Например: Н2 + О2 Н2О - это схема реакции (закон сохранения массы еще не выполняется). Расстановкой коэффициентов добиваются равенства числа атомов каждого химического элемента в левой и правой частях:
2Н2 + О2 = 2Н2О
Теперь это стехиометрическое уравнение, которое показывает соотношение между количествами реагирующих и образующихся веществ. Следует иметь в виду, что в химии соизмеримы только количества веществ (и несоизмеримы в общем случае ни массы, ни объемы). Важнейшим свойством стехиометрических коэффициентов является то, что их можно одновременно умножать и делить на одно и то же число, при этом смысл стехиометрического уравнения не меняется.
Количества веществ, отвечающие стехиометрическому уравнению, называются стехиометрическими. Например, для приведенного выше уравнения стехиометрическими количествами будет 2 моль водорода, 1 моль кислорода и 2 моль воды, или 0,4 моль водорода, 0,2 моль кислорода и 0,4 моль воды, и, вообще говоряV моль водорода, 0,5V моль кислорода и V моль воды. В общем виде уравнение любой химической реакции можно записать в виде:
аA + bB = cC + dD
где строчные буквы обозначают стехиометрические коэффициенты, а заглавные – формулы веществ. При этом, если, например известно количество вещества А, количество вещества С может быть рaссчитно по формуле:

Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные соотношения между реагирующими веществами. Исключительное значение для развития химии имело установление основных стехиометрических законов.
1. Закон сохранения массы веществ (М. В. Ломоносов, 1748-1756 гг., А. Лавуазье, 1777 г.).
Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции.
Закон сохранения массы веществ может быть объяснен с точки зрения атомно-молекулярного учения так: при химических реакциях атомы не исчезают и не могут возникать из ничего; общее число атомов остается постоянным до и после реакции. Например, при взаимодействии двухатомных молекул водорода и хлора должно образоваться столько молекул НС1, чтобы число атомов водорода и хлора оставалось равным двум, т.е. две молекулы:
И поскольку атомы имеют постоянную массу, не меняется и масса веществ до и после реакции.
Закон сохранения массы веществ М. В. Ломоносов связывал с законом сохранения энергии (количества движения). Он рассматривал эти законы в единстве как всеобщий закон природы.
Таким образом, законы сохранения массы веществ и сохранения энергии — это две стороны единого закона природы — закона вечности материи и ее движения.
Взаимосвязь массы и энергии (она рассматривается в физике) выражают уравнением Эйнштейна:
E=mc2,
где E — энергия; m — масса; c — скорость света в вакууме.
Закон сохранения массы веществ дает материальную основу для составления уравнений химических реакций. Опираясь на него, можно проводить расчеты по химическим уравнениям.
2. Закон постоянства состава вещества (Ж. Л. Пруст, 1808 г.).
Каждое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Например, воду можно получить по любой из следующих реакций:
2Н2+О2=2Н2О
Са(ОН)2=СаО+Н2О
CuSO4•5Н2О=CuSO4+5Н2О
*Химически чистая вода содержит 11,19% водорода и 88,81% кислорода, независимо от способа ее получения, то есть на один атом кислорода приходится два атома водорода. Иной состав свидетельствует либо о наличии примесей, либо о том, что это другое вещество (например, Н2О2).
Ж. Пруст писал: «От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании».
В этой формулировке закона, как и в приведенном выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения.
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества, эквивалентное одному моль катионов водорода в рассматриваемой реакции.
Эквивалентная молярная масса вещества [править]
Молярная масса эквивалентов обычно обозначается как или. Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как).
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Mэкв = fэкв×M
Фактор эквивалентности [править]
Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности (обозначается обычно как).
Число эквивалентности [править]
Число эквивалентности z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности связан с числом эквивалентности z следующим соотношением: =1/z.
Например, в реакции:
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Эквивалентом является частица ½Zn(OH)2. Число ½ есть фактор эквивалентности, z в данном случае равно 2

9. Химическая реакция: определение, признаки, отличие от физических явлений, классификации.
Хими́ческая реа́кция — превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются, в частности не изменяется их общее число, изотопный состав химических элементов, при этом происходит перераспределение электронов и ядер и образуются новые химические вещества.
Классификация
По изменению степеней окисления реагентов[править]
В данном случае различают
Окислительно-восстановительные реакции, в которых атомы одного элемента (окислителя) восстанавливаются, то есть понижают свою степень окисления, а атомы другого элемента (восстановителя) окисляются, то есть повышают свою степень окисления. Частным случаем окислительно-восстановительных реакций являются реакции диспропорционирования, в которых окислителем и восстановителем являются атомы одного и того же элемента, находящиеся в разных степенях окисления.
Пример окислительно-восстановительной реакции — горение водорода (восстановитель) в кислороде (окислитель) с образованием воды:
2H2 + O2 = 2H2O
Пример реакции диспропорционирования — реакция разложения нитрата аммония при нагревании. Окислителем в данном случае выступает азот (+5) нитрогруппы, а восстановителем — азот (-3) катиона аммония:
NH4NO3 = N2O + 2H2O (до 250 °C)
Не окислительно-восстановительные реакции — соответственно, реакции, в которых не происходит изменения степеней окисления атомов, например, указанная выше реакция нейтрализации.
По тепловому эффекту реакции[править]
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей. В некоторых реакциях энергии этих процессов близки, и в таком случае общий тепловой эффект реакции приближается к нулю. В остальных случаях можно выделить:
экзотермические реакции, которые идут с выделением тепла, (положительный тепловой эффект) например, указанное выше горение водорода
эндотермические реакции в ходе которых тепло поглощается (отрицательный тепловой эффект) из окружающей среды.
Тепловой эффект реакции (энтальпию реакции, ΔrH), часто имеющий очень важное значение, можно вычислить по закону Гесса, если известны энтальпии образования реагентов и продуктов. Когда сумма энтальпий продуктов меньше суммы энтальпий реагентов (ΔrH < 0) наблюдается выделение тепла, в противном случае (ΔrH > 0) — поглощение.
По типу превращений реагирующих частиц[править]
соединения:
разложения:
замещения:
обмена (тип реакции-нейтрализация):
обмена (тип реакции-обмена):
Химические реакции всегда сопровождаются физическими эффектами: поглощением и выделением энергии, например в виде теплопередачи, изменением агрегатного состояния реагентов, изменением окраски реакционной смеси и др. Именно по этим физическим эффектам часто судят о протекании химических реакций.
Химические процессы, протекающие в веществе, отличаются и от физических процессов, и от ядерных превращений. В физических процессах каждое из участвующих веществ сохраняет неизменным свой состав (хотя вещества могут образовывать смеси), но могут изменять внешнюю форму или агрегатное состояние.
В химических процессах (химических реакциях) получаются новые вещества с отличными от реагентов свойствами, но никогда не образуются атомы новых элементов. В атомах же участвующих в реакции элементов обязательно происходят видоизменения электронной оболочки.
10.Схема и уравнение химической реакции (алгоритм записи уравнения). Физический смысл стехиометрических коэффициентов. Типы уравнения: полное, неполное, молекулярное, ионное, термохимическое. Привести примеры.
При химических реакциях одни вещества превращаются в другие. Вспомним известную нам реакцию серы с кислородом. И в ней из одних веществ (исходных веществ или реагентов) образуются другие (конечные вещества или продукты реакции).
Для записи и передачи информации о химических реакциях используются схемы и уравнения реакций.
Схема химической реакции – условная запись,дающая качественнуюинформацию о химической реакции.
Схема реакции показывает, какие вещества вступают в реакцию и какие образуются в результате реакции. И в схемах, и в уравнениях реакций вещества обозначаются их формулами.
Схема горения серы записывается так: S8 + O2 SO2.
Это означает, что при взаимодействии серы с кислородом протекает химическая реакция, в результате которой образуется диоксид серы (сернистый газ). Все вещества здесь молекулярные, поэтому при записи схемы использованы молекулярные формулы этих веществ. То же относится и к схеме другой реакции – реакции горения белого фосфора:
P4 + O2 P4O10.
При нагревании до 900 oС карбоната кальция (мела, известняка) протекает химическая реакция: карбонат кальция превращается в оксид кальция (негашеную известь) и диоксид углерода (углекислый газ) по схеме:
CaCO3 CaO + CO2.
Для указания на то, что процесс происходит при нагревании, схему (и уравнение) обычно дополняют знаком " t", а то, что углекислый газ при этом улетучивается, обозначают стрелкой, направленной вверх:
CaCO3 CaO + CO2.
Карбонат кальция и оксид кальция – вещества немолекулярные, поэтому в схеме использованы их простейшие формулы, отражающие состав их формульных единиц. Для молекулярного вещества – углекислого газа – использована молекулярная формула.
Рассмотрим схему реакции, протекающей при взаимодействия пентахлорида фосфора с водой: PCl5 +H2O H3PO4 + HCl.
Из схемы видно, что при этом образуется фосфорная кислота и хлороводород.
Иногда для передачи информации о химической реакции бывает достаточно и краткой схемы этой реакции, например:
S8 SO2; P4 P4O10; CaCO3 CaO.
Естественно, что краткой схеме может соответствовать и несколько разных реакций.
Уравнение химической реакции – условная запись, дающая качественную и количественную информацию о химической реакции.
Для любой химической реакции справедлив один из важнейших законов химии:
При протекании химических реакций атомы не появляются, не исчезают и не превращаются друг в друга.
При записи уравнений химических реакций, кроме формул веществ, используются коэффициенты. Как и в алгебре, коэффициент "1" в уравнении химической реакции не ставится, но подразумевается. Рассмотренные нами реакции описываются следующими уравнениями:
1S8 + 8O2 = 8SO2, или S8 + 8O2 = 8SO2;
1P4 + 5O2 = 1P4O10, или P4 + 5O2 = P4O10;
1CaCO3 = 1CaO + 1CO2, или CaCO3 = CaO + CO2;
1PCl5 + 4H2O = 1H3PO4 + 5HCl, или PCI5 + 4H2O = H3PO4 + 5HCI.
 2018-01-21
2018-01-21 3916
3916







