Реакции диенов отличаются от олефинов. Наибольший интерес представляют реакции присоединения.
1) Галогенирование
Сопряжение π – связей в нереагирующей молекуле характеризуется как статический эффект сопряжения:
 | |||
 | |||





 CH2 = CH – CH = CH2 CH2 – CH – CH – CH2
CH2 = CH – CH = CH2 CH2 – CH – CH – CH2
Под влиянием реагентов сопряжение усиливается и возникает динамический эффект сопряжения. Атака электрофилом или нуклеофилом вызывает перераспределение электронной плотности, поляризацию молекулы диена и приводит к образованию сопряженных карбокатионов и карбоанионов. Воздействие свободных радикалов превращает диен в непредельный радикал, далее эти частицы превращаются в конечный продукт реакции:
 Clδ + – Cl δ - (акцептор
Clδ + – Cl δ - (акцептор
AE электронов)

 CH2 = CH – CH = CH2 + Сl2 H2C = CH
CH2 = CH – CH = CH2 + Сl2 H2C = CH
CH = CH2


 донор электронов – π – комплекс
донор электронов – π – комплекс


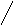

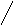


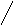
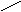




 Cl – CH2 H Cl – CH2 H Cl – CH2 H
Cl – CH2 H Cl – CH2 H Cl – CH2 H

 C + - C ↔ C = C ↔ C δ+ – C Cl–
C + - C ↔ C = C ↔ C δ+ – C Cl–
H CH2 H +CH2 H CH2 δ+

 σ - комплекс
σ - комплекс
4 3 2 1 1



 Cl – CH2 – CH – CH = CH2 + Cl – CH2 H
Cl – CH2 – CH – CH = CH2 + Cl – CH2 H

 Cl C 2 = C 3
Cl C 2 = C 3
H C 4 H2 – Cl
3,4 – дихлорбутен – 1 s – транс – 1,4 – дихлорбутен – 2
π – Комплекс в результате действия катиона хлора на крайний атом углерода превращается в σ – комплекс – сопряженный карбокатион. В этом карбокатионе положительный заряд распределен между вторым и четвертым атомом углерода в результате сопряжения π – связи со свободной p – орбиталью катионоидного атома углерода (С+). Далее каждый из катионоидных атомов углерода (С2 или С4) может быть атакован анионом хлора. В результате реакции образуются два изомера.
Температура, природа растворителя и время реакции существенно влияют на соотношение выделяющихся продуктов реакции, а именно, при низкой температуре получается равное количество изомеров 1,2 – и 1,4 – присоединения; при повышенной температуре и при переходе от хлора к иоду увеличивается количество продуктов реакции 1,4 – присоединения.
Галогены могут присоединяться и по радикальному механизму.
2) Гидрирование
Водород в момент выделения присоединяется в основном в положение 1,4:
 CH2 = CH – CH = CH2 + 2H CH3 – CH = CH – CH3
CH2 = CH – CH = CH2 + 2H CH3 – CH = CH – CH3
бутен – 2
Газообразный водород над никелем Ренея и платиной присоединянтся ко всем четырем атомам углерода и образует насыщенное соединение:
Ni
 CH2 = CH – CH = CH2 + H2 CH3 – CH2 – CH2 – CH3
CH2 = CH – CH = CH2 + H2 CH3 – CH2 – CH2 – CH3
бутан
3) Гидрогалогенирование
Присоединение галогеноводорода происходит в положение 1,4. Механизм реакции АЕ:
Под действием полярной молекулы галогеноводорода происходит поляризация π – связи у диена:
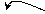
 δ - δ +
δ - δ +
 H + + CH2 = CH – CH = CH2 + Br - CH3 – CH = CH – CH2 Br
H + + CH2 = CH – CH = CH2 + Br - CH3 – CH = CH – CH2 Br
1 – бромбутен – 2
В случае присоединения 1,2 наблюдается присоединение по правилу Марковникова и против правила Марковникова. Это явление объясняет динамический фактор, а именно, образование устойчивого σ – комплекса: чем устойчивее σ – комплекс, тем лучше в этом направлении идет реакция.
+ 1)


 CH3 –CH – CH = CH2 по правилу
CH3 –CH – CH = CH2 по правилу
 CH2 = CH – CH = CH2 + H+ + Марковникова 2)
CH2 = CH – CH = CH2 + H+ + Марковникова 2)

 CH2 – CH2 – CH = CH2 против
CH2 – CH2 – CH = CH2 против
1) Br – правила Марковникова

 CH3 – CH – CH = CH2
CH3 – CH – CH = CH2
Br
2) Br – 3 – бромбутен – 1

 CH2 – CH2 – CH = CH2
CH2 – CH2 – CH = CH2
Br
4 – бромбутен – 1
Галогеноводороды могут присоединяться и по радикальному механизму.
4) Диеновый синтез – реакция Дильса – Альдера
При взаимодействии диенов цис – конфигурации с диенофилами, то есть с молекулами, имеющими активированную двойную связь, электрофильность которой повышена, благодаря сопряжению с электроотрицательным атомом.
 CH2
CH2
CH CH2
δ + δ - || |
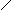

 CH2 = CH – CH = CH2
CH2 = CH – CH = CH2  + CH2 = CH – CH = O CH CH - CHO
+ CH2 = CH – CH = O CH CH - CHO
CH2
Полученное циклическое соединение называется тетрагидробензойный альдегид. Эта реакция широко используется для качественного и количественного определения диеновых углеводородов, а также для синтеза шестичленных циклов.
 2018-01-21
2018-01-21 437
437








