Примером кислотного аккумулятора, широко использующегося для автономного электропитания автомобилей, является свинцовый аккумулятор.
- А Pb │ H2SO4 │ PbO2 K +
- A) Pb0 – 2e → Pb2+; Pb2+ + SO42- → PbSO4
+ K) Pb4+ + 2e → Pb2+; Pb4+O2 + 2e + SO42- + 4H+ → PbSO4 + 2H2O
При сложении левых частей уравнений А) и К) и их правых частей получим суммарное уравнение работы свинцового аккумулятора.
Pb + PbO2 + 2H2SO4 →разрядка 2PbSO4 + 2H2O
←зарядка
ЭДС = 2,1 В; КПД = 80 %. Срок службы 2 -5 лет.
Щелочные аккумуляторы
В железо – никелевом аккумуляторе анодом служит железо, катодом NiOOH, электролитом КОН.
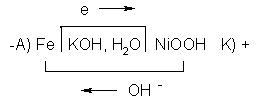
φ0Fe2+∕ Fe0 = - 0,44B; φ0Ni3+∕ Ni2+ = + 0,49B
А) Fe0 →2e + Fe2+; Fe2+ + 2OH- → Fe2+(OH)2
K) 2Ni+3OOH + 2e +2H2O → 2Ni2+(OH)2 + 2OH-
Fe0 + 2Ni+3OOH +2H2O →разрядка 2Ni2+(OH)2 + Fe2+(OH)2
←зарядка
КПД =60 -65% ЭДС = 1,48В
Преимуществом щелочных аккумуляторов является сравнительно малый вес, простота ухода за ними. Срок службы 250-750 циклов.
Обратите внимание на то, что в современных, реально действующих гальванических элементах и анод и катод погружены в один электролит, в отличие от рассматриваемого в начале железо - серебрянного элемента.
Аккумуляторы используются в виде батарей (несколько аккумуляторов) для питания цепей накала (лампы, фонари, нагревательные приборы), измерительных приборов, электродвигателей (электромобили, электрокары, электровозы при отсутствии контакта сети,) телефонов и т.п..
Вывод: Гальванические элементы – это реально существующие автономные генераторы электрического тока. Ток возникает как результат протекания окислительно- восстановительных реакций. Поэтому гальванические элементы - это химические источники электрического тока.
КОРРОЗИЯ МЕТАЛЛОВ
КОРРОЗИЯ -процесс самопроизвольного разрушения металлов и сплавов под действием окружающей среды; данный процесс является окислительно-восстановительным и протекает на границе раздела фаз.
Процесс коррозии характеризуется уменьшением энергии Гиббса системы (G < 0).
ΔG = ΔH – T ΔS,
где Δ Н – изменение энтальпии; Δ Н < 0, т.к. химическая энергия реакции коррозионного разрушения металлов и сплавов выделяется в виде теплоты и рассеивается в окружающем пространстве;
Δ S – изменение энтропии; Δ S > 0, т.к. продукт коррозии имеет более неупорядоченную структуру, чем металл или сплав. Например, железо (Fe) имеет твердую кристаллическую структуру, а продукт коррозии (FeOOH) – рыхлую структуру, которая характеризуется большим значением энтропии;
Т – температура, которая может меняться в различных пределах, в зависимости от условий протекания коррозионного процесса.
При рассмотрении любого коррозионного процесса, можно выделить основные стадии:
1. подвод частиц агрессивной среды (окислителя) к поверхности металла или сплава;
2. закрепление частиц агрессивной среды на поверхности твердой фазы (процесс адсорбции);
3. ослабление связи частиц агрессивной среды;
4. химическое взаимодействие металла или сплава и агрессивной среды;
5. формирование фазы продукта коррозии;
6. отвод продукта коррозии из зоны химической реакции.
По механизму протекания коррозионного процесса, который зависит от характера внешней среды, различают химическую и электрохимическую коррозию.
ХИМИЧЕСКАЯ КОРРОЗИЯ
Химическая коррозия – самопроизвольное разрушение металла или сплава в окислительных средах, которые не проводят электрический ток.
К ней относятся:
а) высокотемпературная коррозия в атмосфере сухих газов, т.е. при отсутствии конденсации влаги на поверхности металла или сплава (сухой воздух, хлор, сероводород и т.д.);
б) коррозия в жидких неэлектропроводных средах. К ним относятся жидкости органического происхождения (бензин, керосин, сернистая нефть и т.д.), а также ряд жидкостей неорганического происхождения (расплавленная сера, жидкий бром и др.).
Сущность химической коррозии сводится к окислительно-восстановительной реакции, которая протекает между металлом или сплавом и окислителем.
Например, хМе + у/2 О2 = МехОу
При окислении металла или сплава образуется пленка продукта коррозии, которая может проявлять различные свойства, т.е. защищать поверхность от дальнейшего окисления или не защищать. Чтобы пленка продукта коррозии обладала защитными свойствами, она должна удовлетворять следующим требованиям:
1. быть сплошной, непористой;
2. иметь хорошее сцепление с металлом;
3. быть химически инертной по отношению к данной агрессивной среде;
4. обладать твердостью и износостойкостью.
ПРИМЕР 1: Рассмотрите процесс коррозии цинковой пластины в атмосфере сухого сероводорода при температуре 400К.
Ответ: В атмосфере любого сухого газа при высоких температурах протекает химическая коррозия, сущность которой, в данном случае, сводится к окислительно-восстановительной реакции между металлом (Zn) и окислителем (H2S):
Zn + H2S = ZnS + H2
Zn – 2e = Zn2+ | 1
2H+ + 2e = H2 |1
Продуктом коррозии является сульфид цинка.
ПРИМЕР 2: Опишите процесс коррозии железного гвоздя, помещенного в бензин, который насыщен кислородом.
Ответ: В чистом виде органические растворители не реагируют с металлами, но в присутствии примесей химическое взаимодействие протекает интенсивно. В данном случае будет протекать химическое взаимодействие между железом и кислородом:
4Fe + 3O2 = 2Fe2O3
Fe – 3e = Fe3+ | 4
O2 + 4e = 2O2- | 3
 2018-01-21
2018-01-21 384
384







