Делятся на: диальдегиды - Н-СО-СО-Н (глиоксаль, этандиаль), Н-СО-СН2-СО-Н (малоновый альдегид, пропандиаль); дикетоны – СН3-СО-СО-СН3 (a-дикетон, диацетил), СН3-СО-СН2-СО-СН3 (b-дикетон, ацетилацетон, пентадион-2,4); альдегидокетоны - СН3-СО-СН2-СО-Н (3-оксобутаналь)
15.7.1. Методы получения.
Методов получения много, прежде всего это реакции окисления гликолей (по аналогии со спиртами).
15.7.2. Химические свойства дикарбонильных соединений.
15.7.2.1. Свойства a-дикарбонильных соединений.
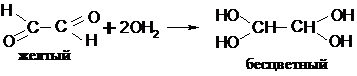 |
Эти соединения проявляют бо’льшую реакционную способность по сравнению с монокарбонильными вследствие взаимного влияния соседних карбонильных групп (проявляют акцепторные свойства). Поэтому d+ на карбонильном углероде увеличивается и возрастает способность к нуклеофильному присоединению. Так, глиоксаль, подобно хлоралю, существует в гидратной форме:
Легко идут и другие реакции, особый интерес представляет образование оксимов:
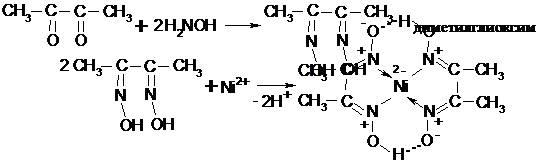
Диоксимы с некоторыми ионами металлов образуют комплексные, хелатные (клешневидные) соединения, например, с Ni2+:
Этот комплекс дает интенсивный красный цвет.
15.7.2.2. Свойства b-дикарбонильных соединений.
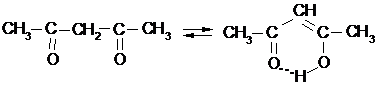 |
Эти соединения способны к кето-енольной таутомерии, причем, они существуют в основном в енольной форме, способной реагировать как по карбонильной, так и по гидроксильной группе:
Наличие двух карбонильных групп в b-положении благодаря индуктивному эффекту в дикетоне и эффекту сопряжения в анионе сильно усиливает кислотность СН2 группы, вследствие чего содержание енольной формы в дикетоне по сравнению с ацетоном возрастает на много порядков, как показано в таблице:
| Вещество | Растворитель | % енольнй формы |
| СН3-СО-СН3 | Без | 0,0002 |
| СН3-СО-СН2-СО-СН3 | Без СН3ОН Н2О | 80 72 17 |
Вода и спирт, сольватируя енольную форму, препятствуют образованию внутримолекулярной водородной связи, которая стабилизирует енол. Тем самым происходит дестабилизация енола, и его доля в равновесии существенно уменьшается.
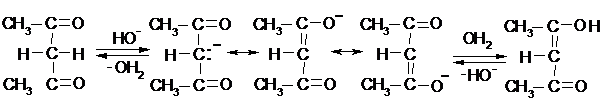 |
Таким образом, ацетилацетон выступает и как С-Н кислота, и как О-Н кислота, образуя при этом один и тот же енолят-анион:
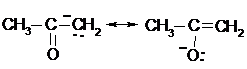 |
Ацетилацетонат-анион (три резонансных структуры) за счет сопряжения стабильнее ацетонат-аниона, для которого существует только две резонансных структуры:
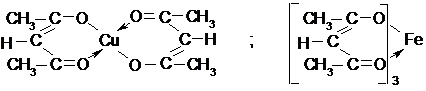 |
Ацетилацетонат-анион является амбидентным (с двумя реакционными центрами), т.е. способным реагировать как по углероду, так и по кислороду. Например, b-дикетоны образуют очень прочные внутримолекулярные еноляты двух и трехвалентных металлов (Cu2+, Fe3+, Cr3+), кристаллические и нерастворимые в воде вещества, но растворимые в органических растворителях типа ацетона или бензола. В случае ацетилацетона образуются ацетилацетонаты:
С реакциями кетонных и енольных форм мы еще встретимся в других подобных случаях.
Лекция № 16.
КАРБОНОВЫЕ КИСЛОТЫ
Введение.
 Карбоновые кислоты – производные углеводородов, содержащие одну или несколько карбоксильных групп -СО-ОН. Название образовалось от названия двух групп:
Карбоновые кислоты – производные углеводородов, содержащие одну или несколько карбоксильных групп -СО-ОН. Название образовалось от названия двух групп:
>С=О карбо нильная

 -ОН гидро ксильная карбоксильная.
-ОН гидро ксильная карбоксильная.
Количество карбоксильных групп в кислоте определяет ее основность. Так:
R-COOH – одноосновные или монокарбоновые,
НОСО-СН2-СООН – двухосновные или дикарбоновые R(COOH)2 и т.д.
Радикалы могут быть насыщенные, ненасыщенные и ароматические. Карбоксильная группа образует ряд важных функциональных производных: R-CO-Сl – хлорангидриды (в общем случае галогенангидриды), R-CO-О-СО-R – ангидриды, R-CO-О-R – сложные эфиры (эстеры), R-CO-NH2 – амиды, R-CºN – нитрилы и т.д.
Кроме того, существуют производные карбоновых кислот, которые наряду с карбоксильной группой содержат гидроксильную, аминогруппу и др. Эти соединения со смешанными функциями относятся к гетерофункциональным производным и будут рассмотрены в следующем разделе.
 2018-02-13
2018-02-13 1667
1667
