При ацетанировании L-сорбозы в начале образуется моноацетонсорбоза. Механизм реакции должен учитывать существовании L-сорбозы в двух формах: в пиранозной и фуранозной, отсюда два самостоятельных направления реакции
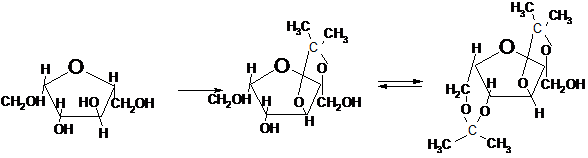
α–L-сорбофураноза α–L-(2:3-изопропи- α–L-(2:3)-(4:6)- диизо-
лиденсурбофураноза пропилиденсурбофура-
ноза)

α–L-сорбопираноза α–L—(1:2) изопропилиден
сорбопираноза
Реакция ацетанирования является обратимой и направление зависит от различных условий:
· Реакция должна проводиться при возможно низкой температуре (12-140С) с последующим охлаждением до -10 0С. По возможности должна быть снижена температура нейтр-ции до 0- +50С для смещения равновесия в сторону образования диацетонсорбозы.
· Не менее важным фактором яаляется присутствие или образование в ходе рекции воды (ацетонные р-ры L-сорбозы очень быстроомыляются в присутствии воды). Источником воды может быть как влажность реагентов, так и вода, образующаяся в ходе реакции.
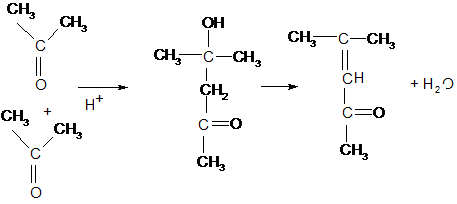
Кетон окись мезитила
8. Приведите схему синтеза гидрата диацетон 2-кето-L-гулоновой кислоты. Объясните выбор окислителя, их достоинства и недостатки 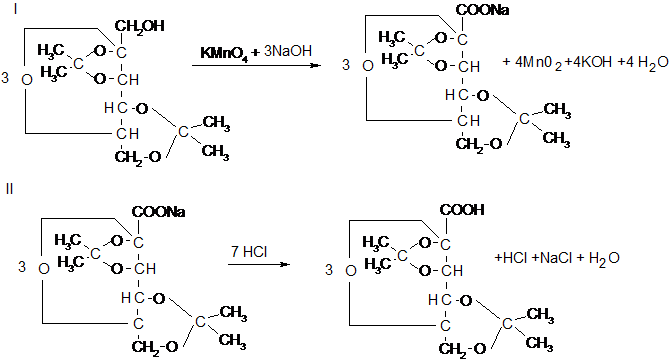 Для окисления диацетона-L-сорбозы предлагают окислители:
Для окисления диацетона-L-сорбозы предлагают окислители:
· KMnO4
· Гипохлорид натрия
· Мантагат калия
· Электролиз в присутствии KMnO4 (25 %).
· Химическое окисление с электрохимической регенерацией окислителя.
Пермангонат калия является очень эффетовным и удобным окислителем, однако его стоимость не дает право быть использованным при производстве аскорбиновой кислоты. Более дешевый окислитель гипохлорид натрия не применяется по санитарным причинам на заводах к крупных городах. Наиболее удобным и перспективным является использование химического окислителя с электрохимической регенерацией окислителя. Метод экологичный и дешевый. Окислителем является NiOOH, который образуется в электролизе по сх:
NiSO4 + 2NaOH = Ni(OH)2 + Na2SO4
анод
 4Ni(OH)2 4 NiOOH +4H+
4Ni(OH)2 4 NiOOH +4H+
-4ē
 2018-02-14
2018-02-14 361
361








