Резерфорд предложил ядерную модель атома: вокруг положительно заряженного ядра, имеющего заряд 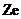 (
(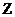 – порядковый номер элемента), по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Кулоновская сила взаимодействия сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности:
– порядковый номер элемента), по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Кулоновская сила взаимодействия сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности: 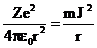 , где
, где 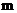 и
и 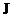 – масса и скорость электрона на орбите радиуса
– масса и скорость электрона на орбите радиуса  . Недостаток уравнения в том, что оно содержит два неизвестных
. Недостаток уравнения в том, что оно содержит два неизвестных 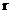 и
и 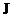 . Следовательно, существует бесчисленное множество значений радиусов и скоростей, а значит и энергий, которая может меняться непрерывно, и следовательно, испускаться любая порция энергии. Этому противоречит линейчатый спектр излучения атомов. Попытки построить теорию атома в рамках классической физики не привели к успеху. Первая попытка построить новую квантовую теорию атома была предложена Бором. В основу теории Бор положил два постулата:
. Следовательно, существует бесчисленное множество значений радиусов и скоростей, а значит и энергий, которая может меняться непрерывно, и следовательно, испускаться любая порция энергии. Этому противоречит линейчатый спектр излучения атомов. Попытки построить теорию атома в рамках классической физики не привели к успеху. Первая попытка построить новую квантовую теорию атома была предложена Бором. В основу теории Бор положил два постулата:
I постулат (постулат стационарных состояний). В атоме существуют стационарные (не изменяющиеся во времени) состояния, в которых он не излучает энергии. Стационарным состояниям соответствуют стационарные орбиты, по которым движутся электроны. Движение электронов по ним не сопровождается излучением электромагнитных волн. В стационарном состоянии атома электрон должен иметь дискретные квантовые значения момента импульса, удовлетворяющие условию: 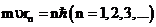 .
.
II постулат (правило частот). При переходе электрона с одной стационарной орбиты на другую излучается или поглощается один фотон с энергией 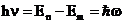 , равной разности энергий соответствующих стационарных состояний.
, равной разности энергий соответствующих стационарных состояний. 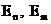 – энергии электрона на соответствующих орбитах. Решая совместно уравнение Резерфорда с условием первого постулата Бора, найдем радиус стационарной орбиты электрона
– энергии электрона на соответствующих орбитах. Решая совместно уравнение Резерфорда с условием первого постулата Бора, найдем радиус стационарной орбиты электрона 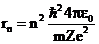 , тогда энергия электрона на
, тогда энергия электрона на 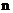 -ой стационарной орбите:
-ой стационарной орбите: 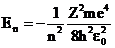 . Полученные энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения
. Полученные энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения 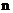 , где
, где 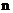 – главное квантовое число. Состояние атома для значения главного квантового числа
– главное квантовое число. Состояние атома для значения главного квантового числа 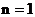 называется основным или нормальным состоянием; если
называется основным или нормальным состоянием; если 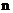 > 1 – состояния называются возбужденными.
> 1 – состояния называются возбужденными.
В квантовой механике состояние электрона в атоме водорода (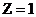 ) описывается волновой функцией
) описывается волновой функцией 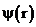 , удовлетворяющей стационарному уравнению Шредингера:
, удовлетворяющей стационарному уравнению Шредингера:
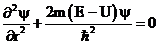 .
.
Потенциальная энергия взаимодействия электрона с ядром 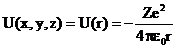 , тогда
, тогда 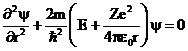 . Решение этого уравнения позволяет найти собственные значения энергии электрона:
. Решение этого уравнения позволяет найти собственные значения энергии электрона:
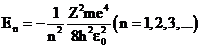 .
.
Энергия принимает дискретные отрицательные значения. Выражение для 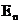 совпадает с формулой, полученной Бором для энергии электрона в атоме водорода, однако, если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой механике дискретные значения энергии вытекают непосредственно из решения уравнения Шредингера.
совпадает с формулой, полученной Бором для энергии электрона в атоме водорода, однако, если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой механике дискретные значения энергии вытекают непосредственно из решения уравнения Шредингера.
Квантовые числа
Квантовые числа – это целые или полу целые числа, определяющие возможные дискретные значения физических величин системы, подчиняющиеся квантовым законам.
Главное квантовое число 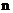 , определяет энергетические уровни электрона в атоме,
, определяет энергетические уровни электрона в атоме, 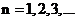 Электроны со значениями энергии, соответствующими главному квантовому числу
Электроны со значениями энергии, соответствующими главному квантовому числу 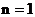 образуют К-оболочку; со значениями
образуют К-оболочку; со значениями 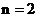 – L-оболочку,
– L-оболочку, 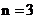 – М-оболочку, и т.д.
– М-оболочку, и т.д.
Из решения уравнения Шредингера вытекает, что механический орбитальный момент импульса электрона квантуется, принимая дискретные значения, определяемые формулой  , где
, где 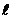 – орбитальное квантовое число. Оно определяет форму орбиты и принимает значения
– орбитальное квантовое число. Оно определяет форму орбиты и принимает значения 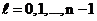 , т.е. всего
, т.е. всего 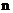 значений. Например, при
значений. Например, при 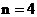 ,
, 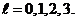 Если
Если 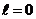 – это s-электрон, при
– это s-электрон, при 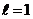 – р-электрон, при
– р-электрон, при 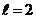 – d-электрон, и т.д.
– d-электрон, и т.д.
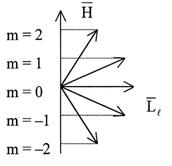 Из решения уравнения Шредингера следует, что вектор
Из решения уравнения Шредингера следует, что вектор 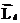 орбитального момента импульса электрона может быть только так ориентирован в пространстве, когда его проекция
орбитального момента импульса электрона может быть только так ориентирован в пространстве, когда его проекция 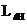 на направление внешнего магнитного поля принимает только квантованные значения
на направление внешнего магнитного поля принимает только квантованные значения 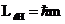 , где
, где 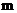 – магнитное квантовое число. Оно определяет проекцию
– магнитное квантовое число. Оно определяет проекцию 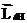 на направление внешнего магнитного поля
на направление внешнего магнитного поля 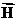 и характеризует ориентацию плоскости электронной орбиты в пространстве, принимая значения
и характеризует ориентацию плоскости электронной орбиты в пространстве, принимая значения 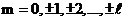 , всего
, всего 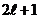 значений ориентаций.
значений ориентаций.
Хотя энергия электрона и зависит только от квантового числа 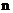 , но каждому собственному значению энергии
, но каждому собственному значению энергии 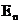 соответствует несколько собственных функций
соответствует несколько собственных функций 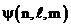 , отличающихся значениями
, отличающихся значениями 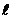 и
и 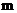 . Значит, атом водорода может иметь одно и то же значение энергии, находясь в различных состояниях. Число различных состояний, соответствующих главному квантовому числу
. Значит, атом водорода может иметь одно и то же значение энергии, находясь в различных состояниях. Число различных состояний, соответствующих главному квантовому числу 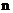 , равно
, равно 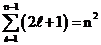 . Состояния с одинаковым значением энергии называются вырожденными, а число таких состояний с одинаковыми значениями энергии называется кратностью вырождения соответствующего уровня. Каждый уровень энергии водородоподобного атома имеет кратность вырождения, равную
. Состояния с одинаковым значением энергии называются вырожденными, а число таких состояний с одинаковыми значениями энергии называется кратностью вырождения соответствующего уровня. Каждый уровень энергии водородоподобного атома имеет кратность вырождения, равную 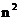 .
.
Спин электрона
Кроме орбитальных магнитного (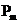 ) и механического (
) и механического (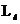 ) моментов электрона, определяющих его движение по орбите, электрон обладает собственным механическим моментом импульса. Он носит название спина -
) моментов электрона, определяющих его движение по орбите, электрон обладает собственным механическим моментом импульса. Он носит название спина - 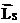 и не связан с движением электрона в пространстве. Следствием наличия спина является существование собственный магнитный момент
и не связан с движением электрона в пространстве. Следствием наличия спина является существование собственный магнитный момент 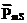 . Эти моменты являются внутренними неотъемлемыми свойствами электрона, такими же, как заряд и масса. Спин может принимать лишь дискретные значения и квантуется по закону
. Эти моменты являются внутренними неотъемлемыми свойствами электрона, такими же, как заряд и масса. Спин может принимать лишь дискретные значения и квантуется по закону 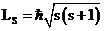 , где
, где 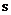 – спиновое квантовое число. Для электрона, протона и нейрона
– спиновое квантовое число. Для электрона, протона и нейрона 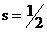 , для фотона
, для фотона 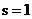 . Проекция спина
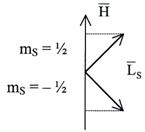
. Проекция спина 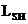 на направление внешнего магнитного поля квантуется так, что вектор
на направление внешнего магнитного поля квантуется так, что вектор 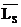 может принимать только
может принимать только 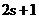 ориентаций. Значит, для электрона (
ориентаций. Значит, для электрона (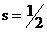 ) всего две ориентации.
) всего две ориентации.
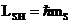 , где
, где 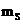 – магнитное спиновое квантовое число. Для электрона оно принимает лишь два значения
– магнитное спиновое квантовое число. Для электрона оно принимает лишь два значения 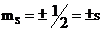 .
.
Все элементарные частицы делятся на два класса.. Частицы с полу целым спином 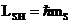 , (
, (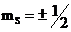 ; электроны, протоны, нейроны) называются фермионами. Частицы с целым спином (
; электроны, протоны, нейроны) называются фермионами. Частицы с целым спином (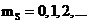 ;
; 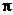 -мезоны, фотоны, фононы) называются бозонами.
-мезоны, фотоны, фононы) называются бозонами.
Принцип Паули
Распределение электронов по энергетическим уровням в атоме подчиняется принципу Паули: в атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел 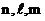 и
и 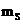 т.е.
т.е. 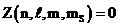 или 1. Поскольку для электрона число
или 1. Поскольку для электрона число 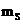 принимает лишь два значения
принимает лишь два значения 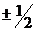 , то на любом энергетическом уровне может находиться не более двух электронов с разными спинами. Максимальное число электронов, находящихся в состояниях, определяемых главным квантовым числом
, то на любом энергетическом уровне может находиться не более двух электронов с разными спинами. Максимальное число электронов, находящихся в состояниях, определяемых главным квантовым числом 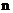 равно
равно 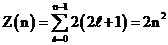 , т.е.
, т.е. 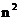 -электронов с
-электронов с 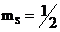 и
и 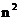 -электронов с
-электронов с 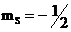 . Отметим, что принципу Паули подчиняется распределение по энергетическим состояниям не только электронов, но и всех фермионов. Распределение бозонов принципу Паули не подчиняется.
. Отметим, что принципу Паули подчиняется распределение по энергетическим состояниям не только электронов, но и всех фермионов. Распределение бозонов принципу Паули не подчиняется.
 2018-02-14
2018-02-14 609
609








