Степень диссоциации электролита можно определить по отклонению понижения температуры кристаллизации в растворе электролита от понижения температуры кристаллизации неэлектролита той же моляльной концентрации.
Опыт проводится на приборе, изображенном на рис. 2. Наружный стакан вместимостью 500 мл заполнен охлаждающей смесью из льда или снега с поваренной солью. Во внутренний стакан вместимостью 100 мл вставлены термометр с ценой деления 0,1 °С со шкалой до минус 3 °С (на какую положительную температуру он рассчитан, не имеет значения) и проволочная мешалка. Прибор можно использовать для различных хорошо растворимых солей: NaCl, KCl, Kl, KNO3, NaNO3.
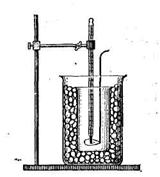
 Получить у преподавателя соль, степень диссоциации которой надо определить. Заполнить наружный стакан почти до верха охлаждающей смесью (снег и поваренная соль). Во внутренний стакан налить 100 мл дистиллированной воды и собрать прибор. Определить температуру кристаллизации (замерзания) чистой воды (она может несколько отклоняться от 0 °С по термометру из-за неточности изготовления последнего). Записывать показания термометра в течение 4 мин через каждые 20 с при периодическом перемешивании. По полученным данным построить график температура—время (удобнее по оси ординат откладывать температуру). Отметить на графике температуру, при которой наблюдается появление первых кристаллов льда, — это и есть температура кристаллизации воды. Иногда вода переохлаждается, и при появлении льда ее температура несколько повышается, а затем снова начинает падать. В этом случае точкой кристаллизации является температура после повышения, но до последнего спуска (см. построенный график). Записать полученную таким образом точку кристаллизации чистой воды.
Получить у преподавателя соль, степень диссоциации которой надо определить. Заполнить наружный стакан почти до верха охлаждающей смесью (снег и поваренная соль). Во внутренний стакан налить 100 мл дистиллированной воды и собрать прибор. Определить температуру кристаллизации (замерзания) чистой воды (она может несколько отклоняться от 0 °С по термометру из-за неточности изготовления последнего). Записывать показания термометра в течение 4 мин через каждые 20 с при периодическом перемешивании. По полученным данным построить график температура—время (удобнее по оси ординат откладывать температуру). Отметить на графике температуру, при которой наблюдается появление первых кристаллов льда, — это и есть температура кристаллизации воды. Иногда вода переохлаждается, и при появлении льда ее температура несколько повышается, а затем снова начинает падать. В этом случае точкой кристаллизации является температура после повышения, но до последнего спуска (см. построенный график). Записать полученную таким образом точку кристаллизации чистой воды.
Второй (сухой) стакан на 100 мл взвесить нa техно-химических весах и затем взвесить в нем количество полученной у преподавателя соли, отвечающее 0,2 моль ее. Прилить 100 мл дистиллированной воды. Размешать соль до полного растворения раствора и описанным выше способом определить температуру кристаллизации раствора по появлению кристаллов, учитывая, что в этом случае также возможно переохлаждение.
Все наблюдения записать в журнал. Результаты измерений записать по следующей форме:
Масса стакана, m1 г.
Масса стакана с солью, m2, г.
Масса соли, m = m2 — m1 г.
Масса воды, m(н2о), г (равна ее объему, мл).
Температура кристаллизации воды, Tкр , °C.
Температура кристаллизации раствора, T'кр , °C.
Рассчитать моляльную концентрацию раствора 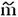 :
:
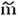 =
= 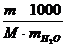 ; моль/кг
; моль/кг
где М — молекулярная масса соли.
Вычислить понижение температуры кристаллизации раствора неэлектролита по следствию из закона Рауля:
ΔТнеэл == КH2O· 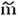 ,
,
где КH2O - криоскопическая постоянная воды, равная 1,86°.
Определить понижение температуры кристаллизации взятого раствора электролита ΔТэл по экспериментальным данным:
ΔТэл = Tкр – T'кр
Чем объясняется отличие этой величины от рассчитанной для раствора неэлектролита?
Найти изотонический коэффициент:

Соотношение между изотоническим коэффициентом и степенью диссоциации α выражается формулой:

где n - число ионов, на которые распадается электролит.
Зная, что все взятые соли - бинарные электролиты, рассчитать кажущуюся степень диссоциации по формуле:
α = i - 1
Почему найденная таким образом степень диссоциации является «кажущейся»? Как она зависит от концентрации соли?
Ответ на последний вопрос можно проверить опытным путем, определив температуру замерзания децимоляльного раствора соли. Для этого описанным выше путем рассчитать и приготовить в стакане децимоляльный раствор той же соли и вновь определить его температуру замерзания.
Лабораторная работа № 7. Гидролиз солей.
Приборы.
15 пробирок, водяная баня, штатив, пипетка 10мл, колба (1л или 100мл), стеклянная палочка, микрошпатель.
Реактивы (кристаллические).
1. Ацетат натрия (CH3COONa∙3H2O)
2. Карбонат натрия (Na2CO3)
3. Карбонат аммония ((NH4)2CO3)
4. Хлорид калия (KCl)
5. Сульфат алюминия (Al2(SO4)3∙18H2O)
6. Сульфит натрия (Na2SO3∙7H2O)
7. Ацетат аммония (CH3COONH4)
Индикаторы. Универсальная индикаторная бумага, раствор лакмуса, фенолфталеин.
Растворы.
1. Ацетата натрия CH3COONa (0,5н);
2. Карбоната натрия Na2CO3 (0,5н);
3. Сульфат алюминия Al2(SO4)3 (0,5н);
4. Хлорида сурьмы (III) SbCl3 (0,5н);
5.Сульфид натрия Na2S (0,5н);
6. Хлорида аммония NH4Cl (0,1М);
7. Хлороводородной кислоты HCl (2н).
Приборы. Водяная баня, 15 пробирок, штатив, пипетка 10мл, колба (1л или 100мл), стеклянная палочка, микрошпатель.
Реактивы (кристаллические). Ацетат натрия, карбонат натрия, карбонат аммония, хлорид калия, сульфит натрия, ацетат аммония, сульфат алюминия.
Индикаторы. Универсальная индикаторная бумага, раствор лакмуса, фенолфталеин.
Растворы. Ацетата натрия (0,5 н); карбоната натрия (0,5 н); сульфат алюминия (0,5 н); хлорида сурьмы (III) (0,5 н); сульфида натрия (0,5 н); хлорида аммония (0,1 М); хлороводородной кислоты (2 н).
 2018-02-13
2018-02-13 1617
1617
