Общая термодинамическая характеристика реакций
Восстановления
Упругость диссоциации оксидов большинства технически важных металлов при температурах пирометаллургических процессов (1000 – 2000 К) очень мала, и получение металлов путем диссоциации оксидов оказывается неэффективным.
Наиболее целесообразно в промышленных условиях получать металлы из оксидов восстановлением – химическим взаимодействием с восстановителем, способным " отбирать " кислород у металла.
Реакцию восстановления металла из его оксида можно представить уравнением
Ме О + В = Ме + В О.
Здесь Ме Ои В О – восстанавливаемый оксид и оксид восстановителя; В – восстановитель; Ме – продукт восстановления (металл или более низший оксид).
Примеры реакций восстановления:
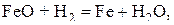




 .
.
Реакцию восстановления можно представить алгебраической суммой реакции образования оксидов
В +  О2 = В О,
О2 = В О,  ;
;
Me +  О2 = Me O,
О2 = Me O,  ;
;
Me O + B = Me + B O,  .
.
Условия протекания реакции восстановления слева направо



Последнее неравенство указывает на большее сродство к кислороду у восстановителя, чем у металла при условиях осуществления процесса.
Если реагенты находятся в стандартных состояниях (чистые вещества), то условие восстановления принимает вид
 .
.
С учетом известных выражений для реакций образования оксидов
 и
и 
условие восстановления может быть записано через упругости диссоциации оксидов  .
.
Отсюда следует, что для протекания процесса восстановления оксид восстановителя В О должен быть устойчивее оксида Ме О.
Если восстановитель – металл, то для осуществления реакции металлотермического восстановления  необходимо
необходимо
 .
.
 2020-01-14
2020-01-14 164
164








