Термодинамическая теория растворов должна отразить в конечном счете зависимость между активностью компонентов и составом раствора.
Для создания «количественных» соотношений теория растворов использует ряд законов статистической термодинамики.
Исходя из какой-либо модели раствора и пользуясь законами статистической физики, получают выражения для химических потенциалов компонентов раствора. Эти выражения затем сравнивают с формальными выражениями для химических потенциалов компонентов в которые входит активность компонента, то есть с выражениями вида:
 (1)
(1)
Рассмотрим методику такого вывода на примере простейшего совершенного молекулярного раствора.
Из основ термодинамики растворов ответ известен.
Химический потенциал компонента (i) совершенного раствора равен
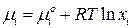 (2)
(2)
Получим данное выражение, исходя из следующей модели раствора.
1. Молекулы растворителя и растворенных веществ расположены в растворе по закону случая.
2. Все частицы раствора энергетически равноценны, что характерно только для совершенного раствора
Для бинарного (двухкомпонентного) раствора
 (3)
(3)
где  – свободная энергия раствора.
– свободная энергия раствора.
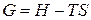 (4)
(4)
 (5)
(5)
Изменение внутренней энергии совершенного раствора 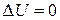 в связи с принятым модельным положением 2.
в связи с принятым модельным положением 2.
 (6)
(6)
Энтропия смешения всегда 
Из статистической термодинамики следует
 , (7)
, (7)
где 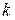 – постоянная Больцмана, равная
– постоянная Больцмана, равная  , где
, где  – число Авогадро.
– число Авогадро.
W – термодинамическая вероятность. Может быть подсчитана как число всех возможных (различимых) перестановок частиц в системе, приводящих к новым конфигурациям в расположении частиц.
 (8)
(8)
Здесь  – общее число всех перестановок частиц,
– общее число всех перестановок частиц,  и
и  – число перестановок частиц I сорта и частиц II сорта.
– число перестановок частиц I сорта и частиц II сорта.
Формула Стирлинга для 
 (9)
(9)
Применяя эту формулу, получим:
 (10)
(10)
 (11)
(11)
 (12)
(12)
 (13)
(13)
 (14)
(14)

Сравним (14) и (2) и учтем, что 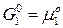 , получим:
, получим:  (15)
(15)
 2020-01-14
2020-01-14 283
283








