Эта теория является первой и наиболее простой статистической теорией ионных растворов, в которой учитывается главная особенность шлаков – наличие зарядов у частиц раствора. Основные положения теории состоят в следующем:
1. раствор состоит только из положительно и отрицательно заряженных частиц (катионов и анионов) и не содержит электронейтральных частиц;
2. ближайшими соседями у каждого иона являются только ионы противоположного знака;
3. энергетическое состояние иона не изменяется при переходе чистого компонента в раствор, то есть раствор образуется без изменения энергии (теплового эффекта);
4. раствор образуется без изменения объема.
В соответствии с первым положением теории состав ионного раствора определяется совокупностью ионных долей катионов (x 1, x 2,..., xi,...) и ионных долей анионов (y 1, y 2,..., yj,...). При этом ионная доля катиона сорта S представляет собой отношение числа катионов (числа молей катионов) сорта S к общему числу всех катионов (числу молей всех катионов):
 . (1)
. (1)
Аналогично ионная доля аниона сорта t:
 . (2)
. (2)
Очевидно, что  и
и  .
.
В теории принимается, что соединения с большой долей ионной составляющей в химической связи (галогениды, основные оксиды) в шлаке находятся в виде простейших ионов, например
NaF ® Na+ + F-, (3)
CaF2 ® Ca2+ + 2F-, (4)
CaO ® Ca2+ + O2-. (5)
Кислые и амфотерные оксиды (соединения с большой долей ковалентной составляющей в химической связи) и галогениды металлов 2 – 5 групп периодической системы образуют в шлаке комплексные анионы, например
 (6)
(6)
 (7)
(7)
В соответствии со вторым положением в теории учитываются взаимные перестановки только разносортных ионов одного знака заряда, а значит общее число независимых перестановок частиц в растворе (число микросостояний системы)
 (8)
(8)
и энтропия раствора
 (9)
(9)
где  – число молей соединения с металлом сорта i и металлоидом сорта j в растворе;
– число молей соединения с металлом сорта i и металлоидом сорта j в растворе;  – мольная энтропия соединения;
– мольная энтропия соединения;  – энтропия образования раствора (энтропия смешения).
– энтропия образования раствора (энтропия смешения).
Из третьего положения теории следует, что внутренняя энергия U и энтальпия H раствора
 (10)
(10)
 (11)
(11)
Тогда свободная энергия Гиббса раствора
 (12)
(12)
а химический потенциал компонента
 (13)
(13)
В частности, для компонентов оксидно-фторидного шлака, образованного оксидами FeO, Al2O3 и фторидами FeF2 и AlF3, имеем
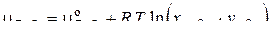 (14)
(14)
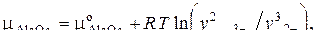 (15)
(15)
 (16)
(16)
 (17)
(17)
и активности компонентов раствора
 (18)
(18)
Расчеты показывают, что теория совершенных ионных растворов может использоваться для определения активностей компонентов в шлаках, в которых малы концентрации кислых и амфотерных оксидов (% SiO2 + %Al2O3 + % P2O5 + % Fe2O3+ +…..< 10 –12%). Это высокоосновные шлаки.
В реальных шлаках основных периодов сталеплавильных процессов содержание кислых и амфотерных оксидов превышает 12%. Поэтому применение ТСИР к ним дает неверные результаты.
Причина неприменимости к ним ТСИР в неверном представлении об энергетической равноценности взаимодействующих в шлаке катионов и анионов.
Ионы в шлаке, обладая различными размерами и зарядами, являются энергетически неравноценными структурными единицами. Шлак не является совершенным ионным раствором. Энергия несовершенного раствора не может быть получена простым (аддитивным) сложением энергий чистых компонентов. Необходимо учитывать прирост или уменьшение энергии раствора при его образовании (смешении) из чистых компонентов – учитывать теплоту смешения 
 2020-01-14
2020-01-14 600
600








