Основания – сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксильных групп.
Ме+1(ОН)n
Классификация:
| Основания | ||||
| По растворимости в воде | Растворимые (щёлочи) NaOH, Ba(OH)2 и ещё 6 щелочей | Нерастворимые Cu(OH)2, Fe(OH)2, Fe(OH)3 | ||
| По количеству ОН-групп | Одиокислотные NaOH, KOH | Двухкислотные Cu(OH)2, Fe(OH)2 | Многокислотные Al(OH)3, Fe(OH)3 | |
| По характеру | Основной ZnOH, Cu(OH)2 | Амфотерный Al(OH)3, Zn(OH)2 | ||
Основания – это электролиты, при диссоциации которых в качестве анионов образуется только гидроксид – ионы.
NaOH ⇄ Na+ + OH–; Ba(OH)2
1) Диссоциируют на ионы NaOH ⇄ Na+ + OH– — изменяют окраску индикатора.
2) С кислотами:
NaOH + HCl → NaCl + H2O
Na+ + OH– + H+ + Cl– → Na+ + Cl– + H2O
OH– + H+ → H2O
3) С кислотными оксидами:
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + 2Na+ + 2OH– → 2Na+ + CO32– + H2O
CO2 + 2OH– → CO32– + H2O
4) С солями:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
5) При нагревании разлагаются:
Cu(OH)2 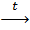 CuO + H2O
CuO + H2O
6) Амфотерные основания:
Zn(OH)2 + 2NaOH 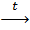 Na2ZnO2 + 2H2O
Na2ZnO2 + 2H2O
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
Применение:
1) в химической промышленности;
2) в производстве сахара и т.п.;
3) в производстве мыла и моющих средств;
Билет №15 (2)
 2020-04-07
2020-04-07 2421
2421








