ОСНОВНЫЕ СВЕДЕНИЯ О МЕТАНЕ
| Общие сведения | |||
| Молекулярная формула СН4 | Графическая
формула
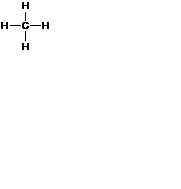
| Структурная
формула
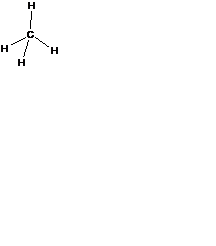
| Электронная
формула
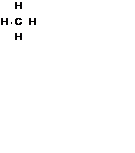
|
| Нахождение в природе Метан содержится в природном газе (от 60 до 98 %), попутном нефтяном газе (от 30 до 80 %). Метан называют болотным или рудничным газом, т.к. он образуется на болотах при гниении растительных остатков без доступа воздуха, а также при медленном разложении каменного угля под землёй. Содержится в атмосфере Сатурна и Юпитера. | |||
| Получение 1) Образуется при крекинге нефти, сухой перегонке древесины, торфа и каменного угля. 2) С +2Н2 *3) CO + 3H2 **4) Al4C3 +12H2O → 3CH4↑ + 4Al(OH)3↓ гидролиз карбида алюминия **5) CH3COONa + NaOH | |||
| Физические свойства Газ без цвета и запаха, очень плохо растворимый в воде. Легче воздуха. | |||
| Химические свойства 1) CH4 + Cl2 2) CH4 + Br2 3) CH4 + HNO3 4) CH4 + 2O2 5) CH4 *5) 2CH4 | |||
| Применение 1) Является сырьём для получения своих гомологов, ацетилена, метанола (метилового или древесного спирта), муравьиного альдегида (метаналя или формальдегида), сероуглерода (CS2), синильной кислоты (HCN), различных хлорпроизводных (например, хлороформа – СНCl3, тетрахлорметана – СCl4), а также фреонов (СF2Cl2) и сажи. 2) В быту и на производстве как газообразное топливо. | |||
ОСНОВНЫЕ СВЕДЕНИЯ Об эТАНЕ
| Общие сведения | ||
| Молекулярная формула С2Н6 | Графическая
формула
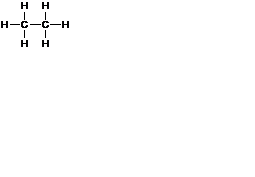
| Электронная
формула
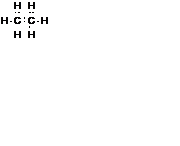
|
| Нахождение в природе Этан содержится в природном газе (от 1 до 10 %), попутном нефтяном газе (от 4 до 25 %). | ||
| Получение 1) С2H4+ Н2 2) С2H2 +2Н2 **3)2CO + 5H2 **4)2CН3I +2Na **5) C2H5COONa + NaOH **6) 2CH3COONa + 2H2О реакция А.В.Г. Кольбе | ||
| Физические свойства Газ без цвета, запаха и вкуса, плохо растворимый в воде. | ||
| Химические свойства 1) C2H6 + Cl2 2) C2H6 + Br2 3) 2C2H6 + 7O2 4) C2H6 5) C2H6 | ||
| Применение Является сырьём для получения своих гомологов, этилена, этанола (этилового спирта), уксусного альдегида (этаналя или ацетальдегида), уксусной кислоты, различных галогенпроизводных (например, бромэтана – С2Н5Br), пластмасс, синтетических волокон, а также как газообразное топливо. | ||
 2020-06-08
2020-06-08 586
586
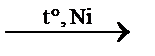 CH4↑ прямой синтез
CH4↑ прямой синтез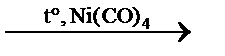 CH4↑ + H2O синтез Ф.Фишера–Г.Тропша
CH4↑ + H2O синтез Ф.Фишера–Г.Тропша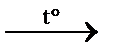 3CH4↑ + Na2CO3 реакция Ж.Б.А. Дюма
3CH4↑ + Na2CO3 реакция Ж.Б.А. Дюма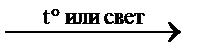 CH3Cl + HCl↑ замещение (хлорирование)
CH3Cl + HCl↑ замещение (хлорирование)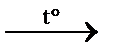 CH3Br + HBr↑ замещение (бромирование)
CH3Br + HBr↑ замещение (бромирование)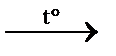 CO2↑ + 2H2O горение
CO2↑ + 2H2O горение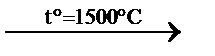 C2H2↑ + 3H2↑ пиролиз
C2H2↑ + 3H2↑ пиролиз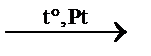 C2H6↑ гидрирование этилена
C2H6↑ гидрирование этилена 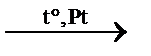 C2H6↑ гидрирование ацетилена
C2H6↑ гидрирование ацетилена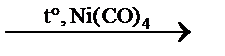 C2H6↑ + 2H2O синтез Ф.Фишера–Г.Тропша
C2H6↑ + 2H2O синтез Ф.Фишера–Г.Тропша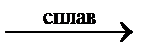 C2H6↑ + 2NaI синтез Ш.А. Вюрца
C2H6↑ + 2NaI синтез Ш.А. Вюрца C2H6↑ + 2NaОН + 2CO2↑ + Н2↑
C2H6↑ + 2NaОН + 2CO2↑ + Н2↑






