Модификация липопротеинов - изменение нормальной структуры белков и липидов в составе ЛП. Модифицированные липопротеины образуются в организме из нормально синтезированных и секретированных в кровь ЛП. Из всех классов ЛП перекисное окисление липидов затрагивает в первую очередь ЛПНП.
Основные причины:
• гликирование апоВ-100 в составе ЛПНП или апоВ-100-рецепторов. В норме у здоровых людей с очень небольшой скоростью протекает неферментативное гликирование этих белков. Остатки глюкозы присоединяются к свободным H2N-группам белков, изменяется их конформация. При повышении концентрации глюкозы в крови
(особенно сахарном диабете) этот процесс возрастает. Модифицированные ЛПНП* не узнаются рецепторами и остаются в крови. Гликирование ЛПВП, напротив, ускоряет катаболизм этих частиц и снижает, тем самым их уровень в крови. Гликилирование ЛП следует рассматривать как их атерогенную модификацию.
• перекисное окисление липидов: в процессе модификации ЛПНП окисляются как липиды, так и апопротеины.
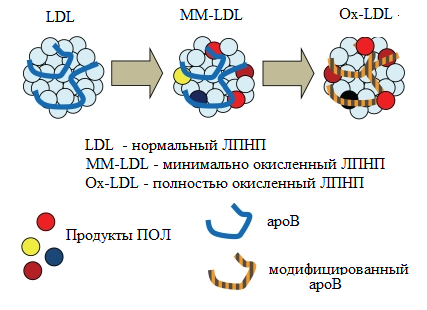 Рис.8 Перекисная модификация липопротеинов очень низкой плотности Рис.8 Перекисная модификация липопротеинов очень низкой плотности | В результате свободно-радикального окисления полиненасыщенных жирных кислот ФЛ, ТАГ и ЭХС в составе ЛПНП образуются:гидроперекиси и диеновые конъюгаты (первичные продукты), которые очень нестабильны. При участии металлов переменной валентности |
они быстро превращаются во вторичные (альдегиды и диальдегиды) и третичные (шиффовы основания) продукты перекисного окисления липидов. При этом образуются «минимально» окисленные ЛПНП. Полное окисление ЛПНП происходит, когда продукты ПОЛ реагируют уже с апоВ, что изменяет его заряд, конформацию и снижает сродство к апоВ-100-рецепторам.
Перекисно-модифицированные ЛП характеризуются следующими призна-
ками:
- слабо распознаются В, Е-рецепторами и легко взаимодействуют со ске-
венджер-рецепторами; при этом макрофаги быстро трансформируются в
пенистые клетки;
- в силу своей цитотоксичности легко повреждают эндотелиальный покров
артерий;
·- ингибируют репарацию эндотелия;
- стимулируют хемотаксис моноцитов в интиму.
· формирование аутоиммунных комплексовЛП-антитело:
(модифицированные ЛП приобретают аутоантигенные свойства, воспринимаются как чужеродные для организма и становиться причиной образования аутоантител). В крови пациентов с атеросклеротическими признаками часто обнаруживают иммунные комплексы, содержащие ЛП в качестве антигена: ЛПНП-IgG или ЛПОНП-IgG.
Аутоиммунные комплексы:
1) вызывают повреждение эндотелия и тем самым ускоряют проникновение липопротеинов в сосудистую стенку;
2) продлевают циркуляцию липопротеинов в крови и задерживают окисление и экскрецию холестерина с желчью, то есть способствуют развитию гиперхолестеролемии;
3) проявляют цитотоксическое действие.
· образование копмлексов ЛП с гликозаминогликанами
Липопротеины низкой плотности, циркулирующие в крови человека, являются источником ХС, способным накапливающихся в сосудистых клетках. Однако нормальные ЛПНП сами по себе не оказывают повреждающего воздействия на артериальную стенку, пока не происходит их распад с освобождением холестерола, который не метаболизируется в артериальной стенке и оказывает на нее повреждающее действие.
Эндотелий в норме способен к регулируемому захвату ЛПНП с участием:
· апоВ-100-рецепторов, что не приводит к накоплению холестерина, так как он полностью используется в соответствии с потребностями клеток
· макрофагов, которые поглощают избыток ЛПНП с помощью скевенджер-рецепторов (англ. scavenger — «мусорщик») - рецепторов-«мусорщиков») и предотвращают перегрузку клеток эндотелия сосудов холестерином. Этот процесс регулируется по принципу обратной связи: при заполнении макрофага достаточным количеством ЛПНП чувствительность рецепторного аппарата макрофага к ЛПНП резко падает и он перестает их поглощать.
В норме количество ЛПНП, транспортируемых с помощью скевенджер-рецепторов, меньше, чем количество ЛПНП, переносимых с помощью рецепторов к ЛПНП.
При гиперхолестеролемии, обусловленной повышенным уровнем ЛПНП, или при модификации ЛПНП снижается вероятность их взаимодействия с апоВ-100-рецепторами. Главный поток ХС во внутреннюю стенку сосудов осуществляется с помощью скевенджер-рецепторов, так как модифицированные ЛПНП слабо распознаются апо-В-рецепторами, но быстро распознаются скевенджер — рецепторами. Этот процесс не регулируется количеством поглощенного ХС, как в случае его поступления в клетки через специфические рецепторы. Причем вероятность подобного захвата пропорциональна увеличению содержания ЛПНП в плазме и их химической модификации (т.е, чем выше уровни циркулирующих ЛПНП*, тем более вероятно их попадание в артериальную стенку).
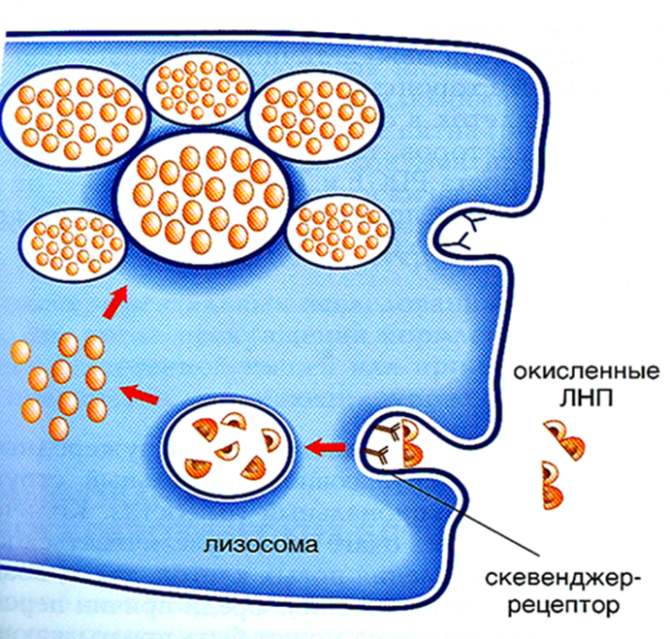 Рис.9 Захват ЛПНП скевенджер рецепторами макрофагов Рис.9 Захват ЛПНП скевенджер рецепторами макрофагов | Количество скевенджер-рецепторов не регулируется ХС, поэтому макрофаги захватывают очень много модифицированных ЛПНП*и превращаются в «пенистые клетки». Такое название связано с тем, что при обработке срезов ткани из макрофагов вымываются липиды. Под микроскопом вакуоли, образовавшиеся после удаления липидов, напоминают пену. |
«Порочный круг» в циркуляции холестерина и липопротеинов
При увеличении концентрации ХС в пище у здорового человека уменьшается его синтез в печени, так как ХС подавляет экспрессию гена регуляторного фермента ГМГ-КоА-редуктазы.
Эндогенный ХС, 80% которого синтезируется в печени, поступает в кровь составе ЛПОНП и затем в составе ЛПНП доставляется в периферические ткани. Избыточное количество ХС-ЛПНП в процессе «обратного транспорта» поглощается клетками печени при участии апоВ-100-рецепторов ЛПНП. В обогащенных ХС гепатоцитах угнетается синтез рецепторов к ЛПНП, поэтому транспорт ЛПНП и ХС в печень уменьшается. Так происходит в норме.
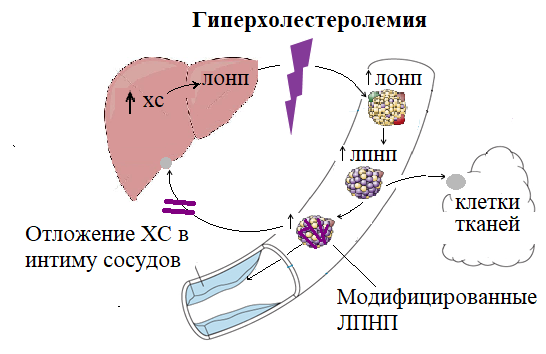 Рис.10 «Порочный круг» в циркуляции холестерина и липопротеинов Рис.10 «Порочный круг» в циркуляции холестерина и липопротеинов | При мутационной и/или химической модификации белков ЛПНП, либо их рецепторов такое динамическое равновесие между синтезом и поступлением избыточного холестерола в печень нарушается. |
Из-за отсутствия возможности комплементарного связывания с соответствующими рецепторами уровень. и продолжительность циркуляции в крови модифицированных ЛПНП значительно повышается. Торможение «обратного» потока ХС из крови в печень усиливает синтез эндогенного ХС и выброс новых порций ЛПОНП, превращающихся опять в ЛПНП, обогащенные холестеролом. Так возникает «порочный круг» в циркуляции ХС и ЛПНП, для которого характерно быстрое прогрессирование атеросклероза. При высокой концентрации ЛПНП в крови и их модификации усиливается транспорт ЛПНП и ХС в стенку сосуда при участии в основном моноцитов-макрофагов и их скевенджер-рецепторов.
 2020-06-29
2020-06-29 998
998








