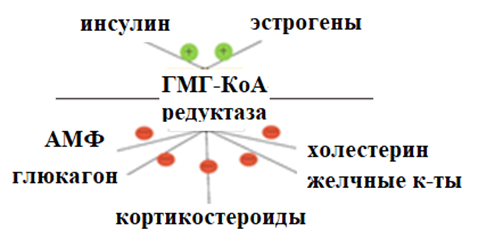
· Регуляция на уровне транскрипции: стероиды - холестерол и желчные кислоты - подавляют транскрипцию гена ГМГ-КоА-редуктазы и синтез этого фермента.
· Регуляция протеолиза ГМГ-КоА-редуктазы: холестерол и желчные кислоты не только снижают синтез новых молекул ГМГ-КоА редуктазы, но и стимулируют их протеолиз, т.е. деградацию функционально активного фермента.
 В печени под влиянием эстрогенов замедляется превращение
В печени под влиянием эстрогенов замедляется превращение
ХС в желчные кислоты (регуляторный фермент 7α-гидроксилаз), а йодтиронины наоборот ускоряют эту трансформацию. Избыток ХС в клетке репрессирует синтез ЛПНП-рецепторов, но эстрогены и йодтиронины увеличивают на поверхности клеток паренхиматозных органов количество этих рецепторов и поэтому уменьшают в крови содержание ХС и ЛПНП.
Поэтому при гипотиреозе развивается гиперхолестеринемия и вторично- атеросклероз. А у женщин доклимактерического периода уровень общего ХС в крови несколько ниже по сравнению с мужчинами. Однако содержание ХС в гепатоцитах и желчи у женщин выше. В результате у женщин чаще образуются холестериновые камни в желчных путях (желчно-каменная болезнь).
После менопаузы при отсутствии заместительной терапии эстрогенами указанные отличия между женщинами и мужчинами нивелируются
Регуляция синтеза холестерола, ЛПНП-рецепторов и
желчных кислот
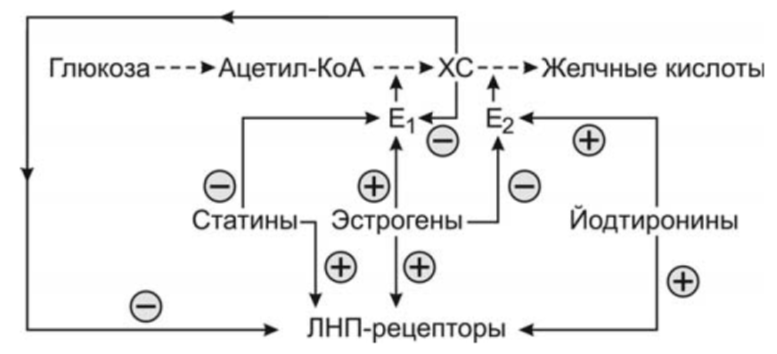
| 
|
| Е1 — ГМГ-КоА-редуктаза; Е2 — 7α-гидроксилаза; «–» — ингибирующий эффект; «+» — активирующий эффект | |
Обратный транспорт холестерина
Практически весь холестерол, который должен быть выведен из организма, поступает в печень и уже из этого органа выделяется в виде производных с фекалиями. Путь возвращения холестерола в печень называют «обратным транспортом» холестерола. Холестерол из всех тканей возвращается в печень в составе ЛПНП, ЛППП и ЛПВП.
В «обратном» транспорте холестерола особую роль играют ЛПВП, которые выводят его избыток из тканей и крови в печень. Поэтому именно эта фракция липопротеинов является «антиатерогенной».
ЛПВП формируются в печени и незначительно в тонком кишечнике в виде ЛПВПпредшественников. Предшественники ЛПВП практически не содержат холестерола и ТАГ. В крови они обогащаются холестеролом, получая его из других ЛП и мембран клеток. Первоначально ЛПВП предш. имеют дисковидную форму, содержат наибольшее по сравнению с другими частицами количество фосфолипидов и белков (основные белки – это апопротеины А-I, С-II, Е) и фермент лецитин-холестерол-ацилтрансферазу (ЛХАТ).
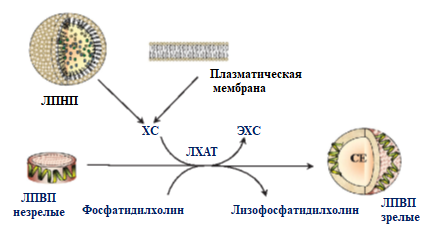
| Фермент ЛХАТ - превращает холестерол, имеющий гидроксильную группу, выступающую на поверхность липопротеинов или мембран клеток, в эфиры холестерола. |
| Рис. 3 Роль ЛХАТ |
Радикал жирной кислоты переносится от фосфатидилхолина (лецитина) на гидроксильную группу холестерола. Реакция активируется апопротеином А-I, входящим в состав ЛПВП. Гидрофобная молекула эфира холестерола перемещается внутрь и ЛПВП обогащаются ЭХС. ЛПВП увеличиваются в размерах, из дисковидных небольших частиц превращаются в частицы сферической формы, которые называют ЛПВП3, или «зрелые ЛПВП». ЛПВП3 в крови частично обменивают ЭХС на ТАГ, содержащиеся в ЛПОНП, ЛППП и ХМ. В этом переносе участвует «белок, переносящий эфиры холестерола». Таким образом, часть эфиров холестерола переносится на ЛПОНП, а ЛПВП3 за счёт накопления триацилглицеролов увеличиваются в размерах и превращаются в ЛПВП2. ЛПОНП и ЛППП под действием ЛП-липазы превращаются в ЛПНП, которые и доставляют холестерол в печень. Часть ЛПВП2 захватывается клетками печени, взаимодействуя со специфическими для ЛПВП рецепторами к апоА-I. На поверхности клеток печени фосфолипиды и триацилглицеролы ЛППП, ЛПВП2 гидролизуются печёночной ЛП-липазой, что дестабилизирует структуру поверхности ЛП и способствует диффузии холестерола в гепатоциты. ЛПВП2 в результате этого опять превращаются в ЛПВП3 и возвращаются в кровоток. Изменения в составе частиц восстанавливают их антиатерогенные свойства, т.е. способность «собирать» холестерол из ЛПНП крови и мембран клеток.
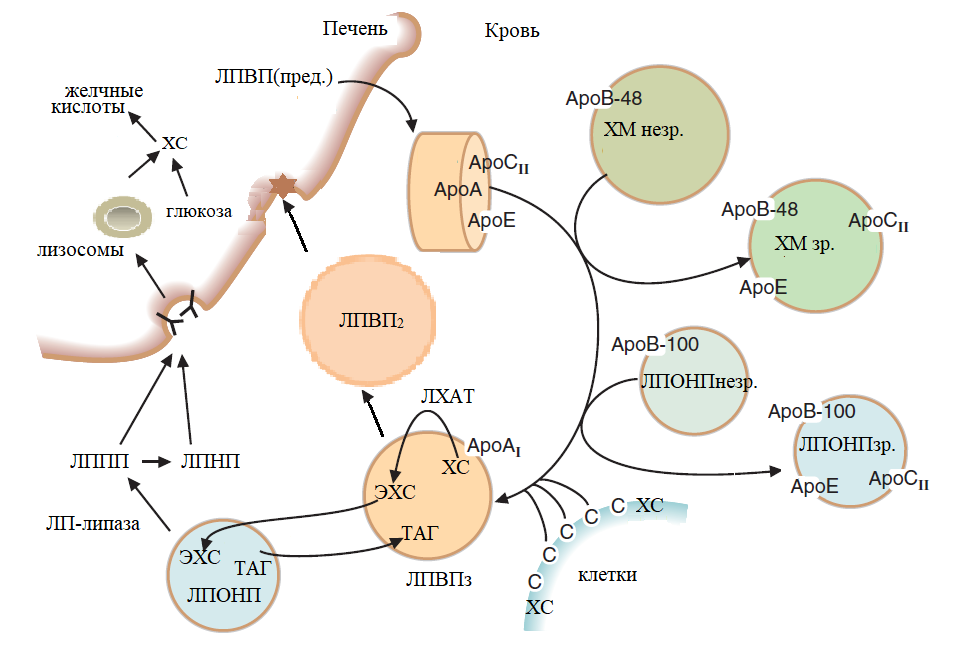 Рис. 4 Роль липопротеинов в «обратном» транспорте холестерла
Рис. 4 Роль липопротеинов в «обратном» транспорте холестерла
|
Освободившийся в цитозоле гепатоцитов ХС включается в общий фонд ХС клеток, который складывается из:
1) пищевого ХС;
2) вновь синтезированного ХС;
3) ХС, поступившего в гепатоциты в составе ЛПВП;
4) ХС, поступившего в гепатоциты в составе ЛПНП и ЛПОНП;
Фонд ХС гепатоцитов расходуется ими на:
1) формирование собственных мембран;
2) формирование ЛОНП;
3) на синтез желчных кислот.
 Структурная основа холестерола – кольца циклопентанпергидрофенантрен не может быть расщеплен до СО2 и воды, как другие органические компоненты, поступающие с пищей или синтезированные в организме. Поэтому основное количество холестерола выводится в виде жёлчных кислот.
Структурная основа холестерола – кольца циклопентанпергидрофенантрен не может быть расщеплен до СО2 и воды, как другие органические компоненты, поступающие с пищей или синтезированные в организме. Поэтому основное количество холестерола выводится в виде жёлчных кислот.
| Рис.5 Общая схема «обратного» транспорта холестерола в печень |
 2020-06-29
2020-06-29 312
312








