Есть и другие способы выражения концентрации растворов, определяемые аналогично пунктам а), б), в) и г). Так, доля может быть не только массовая и мольная, но и объёмная. Отношение может быть не только мольное, но и массовое и объёмное, а процентная концентрация может быть не только массовой, но и мольной и объёмной.
Масса раствора и объём раствора связаны через плотность раствора:
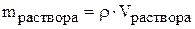 .
.
Плотность раствора, как правило, имеет размерность г/мл, но численное значение не изменяется и если размерность кг/л.
1 кг = 1000 г
1 л = 1000 мл
1 л = 1 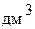
1 мл = 1 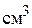
Теперь приступим к решению задачи. В условии задачи даны титр и плотность раствора: Т=0,659 г/мл и 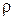 =1,375 г/мл.
=1,375 г/мл.
Пусть объём раствора равен 1000 мл (объём раствора можно принять равным любому числу, ответы не изменятся).
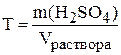 .
.
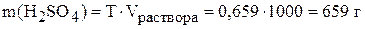 ,
,
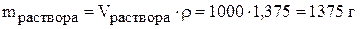 .
.
а) Найдём массовую процентную концентрацию:
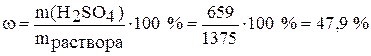 .
.
б) Найдём мольную долю и мольное отношение. Если 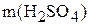 =659 г, а
=659 г, а 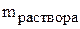 =1375 г, то масса воды:
=1375 г, то масса воды:
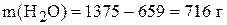 ,
,
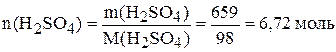 ,
,
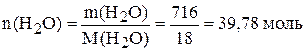 ,
,
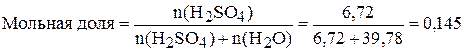 ,
,
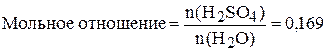 .
.
в) Найдём молярность раствора:
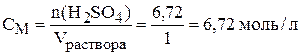 .
.
(Напомним, что объём надо подставить в литрах, 1000 мл = 1 л. Мы приняли объём раствора равным 1000 мл).
г) Найдём моляльность раствора:
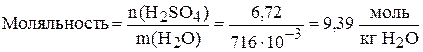 .
.
Обратите внимание, что моляльность всегда больше молярности. Чем более концентрированный раствор, тем разница между ними больше. В очень разбавленных растворах численные значение моляльности и молярности очень близки.
Пример 2. К какому объёму 10 мас.% раствора хлорной кислоты (плотность раствора 1,060 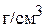 ) надо добавить 50 мл 50 мас.% раствора этой же кислоты (плотность раствора 1,409
) надо добавить 50 мл 50 мас.% раствора этой же кислоты (плотность раствора 1,409 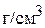 ) для получения 18 мас.% раствора? Найдите объём полученного раствора, если его плотность равна 1,114
) для получения 18 мас.% раствора? Найдите объём полученного раствора, если его плотность равна 1,114 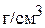 .
.
Решение. Это задача на приготовление раствора. В данном случае надо из двух растворов 10 мас.% и 50 мас.% получить 18 мас.%. Этот же раствор можно получить и иными способами, например, взять более концентрированный раствор (25 мас.%) и разбавить водой.
Предлагаемый подход к решению задачи применим к разным способам приготовления раствора.
Обозначим массу, объём, плотность 10 мас.% раствора индексами 1, для 50 мас.% раствора – индексами 2, а для получаемого 18 мас.% раствора – индексами 3.
Тогда в соответствии с законом сохранения массы можно записать два уравнения: баланс общий и баланс по растворённому веществу
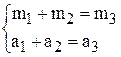
здесь m – масса раствора, а – масса растворённого вещества (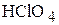 ).
).
Преобразуем уравнение:
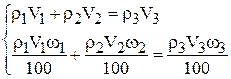
У нас два уравнения и два неизвестных 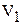 и
и 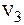 . Очевидно, что решая систему из двух уравнений, можно найти две неизвестные величины.
. Очевидно, что решая систему из двух уравнений, можно найти две неизвестные величины.
Подставим известные значения:
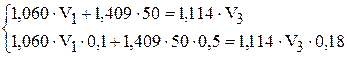
или
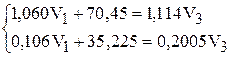
Решая систему, находим:
Объём 10 % раствора 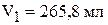 .
.
Объём 18 % раствора 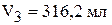 .
.
Объём полученного раствора лишь приблизительно равен сумме объёмов. Объёмы растворов нельзя складывать, нельзя вычитать, так как не существует закона сохранения объёма. Все операции можно производить только с массами.
Пример 3. Сколько граммов глауберовой соли (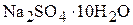 ) и какой объём 10 мас.% раствора
) и какой объём 10 мас.% раствора 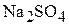 надо взять для приготовления 200 мл 15 мас.% раствора? Плотности растворов равны соответственно 1,09
надо взять для приготовления 200 мл 15 мас.% раствора? Плотности растворов равны соответственно 1,09  и 1,14
и 1,14 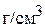 .
.
Решение. Обозначим индексами 1 значения для глауберовой соли, индексом 2 – для 10 мас.% раствора 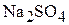 , индексом 3 – для 15 мас.% раствора
, индексом 3 – для 15 мас.% раствора 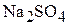 .
.
Напишем два балансовых уравнения: для всех компонентов раствора и для растворённого вещества (см. решение примера 2).
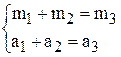
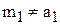 , так как глауберова соль содержит наряду с
, так как глауберова соль содержит наряду с 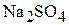 и воду. Найдём содержание
и воду. Найдём содержание 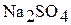 в глауберовой соли в мас.%.
в глауберовой соли в мас.%.
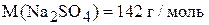 ,
,
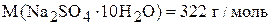 ,
,
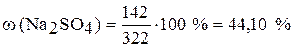 .
.
Тогда получим:
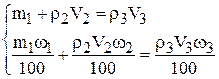
Подставим в систему уравнений значения:
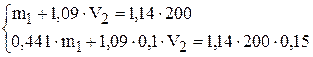
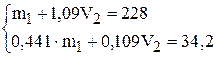
Решение системы уравнений приводит к
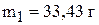 ,
,
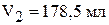 .
.
Пример 4. В каком объёме воды надо растворить 30 л хлороводорода (объём измерен при н.у.), чтобы получить 10 мас.% раствор соляной кислоты? Найдите объём полученного раствора, если его плотность равна 1,047 г/мл.
Решение. Обозначим величины для воды индексом 1, для хлороводорода – индексом 2, для раствора соляной кислоты – индексом 3.
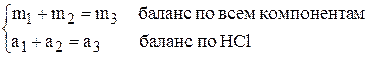
Очевидно, что вода не содержит HCl, значит 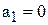 . Хлороводород содержит только HCl, поэтому
. Хлороводород содержит только HCl, поэтому 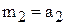 .
.
Найдём массу хлороводорода:
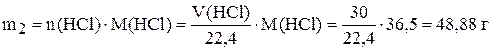 .
.
Подставим значения в систему уравнений:
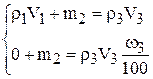
Плотность воды равна 1,00 г/мл.
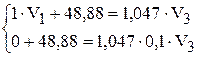
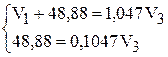
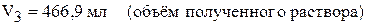 ,
,
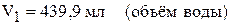 .
.
Пример 5. До какого объёма следует упарить 300 мл 1,2 М раствора 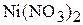 , чтобы получить раствор, содержание растворённого вещества в котором составляет 35 мас.%, а плотность раствора равна 1,370
, чтобы получить раствор, содержание растворённого вещества в котором составляет 35 мас.%, а плотность раствора равна 1,370 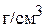 .
.
Решение. Обозначим индексом 1 величины для исходного раствора, индексом 2 – для удаляемой при выпаривании воды, индексом 3 – для полученного раствора.
Запишем уравнения материального баланса (общего баланса и баланса по 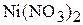 ):
):
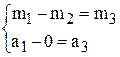
При упаривании раствора содержание соли не меняется.
Преобразуем:
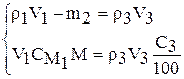
Из второго уравнения можно сразу найти 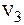 :
:
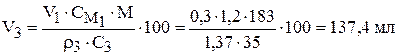
Обратите внимание на размерность величин в числителе при расчёте массы 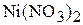
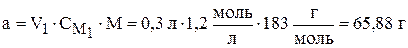
В то же время получаемый объём 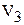 будет в миллилитрах, так как размерность плотности г/мл.
будет в миллилитрах, так как размерность плотности г/мл.
Пример 6. Смешали 1 л 1 М раствора, 2 л 2 М раствора и 3 л 3 М раствора NaOH. Найдите молярную концентрацию полученного раствора, объём которого стал равным 5,99 л.
Решение. Объём полученного раствора не равен сумме объёмов, а несколько отличается (5,99 и 6,00).
Составим уравнение материального баланса по растворённому веществу. Обозначим индексами 1 величины для 1 М раствора, индексами 2 – для 2 М раствора, индексами 3 – для 3 М раствора, индексами 4 – для полученного раствора. Тогда
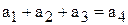 ,
,
где а – масса растворённого вещества в соответствующих растворах. Очевидно, что баланс будет и по количеству вещества NaOH:
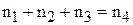 .
.
Концентрации растворов в задаче выражены в моль/л (молярность).
Очевидно, что 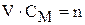 . Тогда
. Тогда
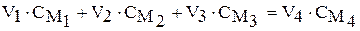 ,
,
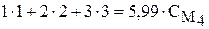 ,
,
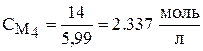 .
.
Аналогичный подход можно использовать и в задачах на разбавление раствора, если концентрации выражены в 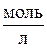 или
или 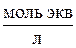 (молярность или нормальность).
(молярность или нормальность).
Вариант 1
1. Определите мольную долю 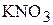 , мольное отношение, молярность, моляльность и титр водного раствора, содержание
, мольное отношение, молярность, моляльность и титр водного раствора, содержание 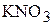 в котором составляет 14 мас.%, а плотность раствора равна 1,09
в котором составляет 14 мас.%, а плотность раствора равна 1,09  . (0,0282; 0,0290; 1,51 моль/л; 1,61 моль/кг; 0,153 г/мл)
. (0,0282; 0,0290; 1,51 моль/л; 1,61 моль/кг; 0,153 г/мл)
2. Какой объём 4 мас.% раствора 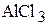 и какой объём 8 мас.%
и какой объём 8 мас.% 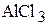 необходимо взять для приготовления 200 мл 5 мас.% раствора
необходимо взять для приготовления 200 мл 5 мас.% раствора 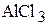 ? Плотности растворов соответственно равны 1,034
? Плотности растворов соответственно равны 1,034  ; 1,071
; 1,071  ; 1,043
; 1,043  . (151,3 мл; 48,7 мл)
. (151,3 мл; 48,7 мл)
3. 24,6 г 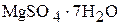 растворили в 200 мл раствора
растворили в 200 мл раствора 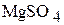 , содержащего 10 мас.% сульфата магния. Плотности исходного и приготовленного растворов соответственно равны 1,102
, содержащего 10 мас.% сульфата магния. Плотности исходного и приготовленного растворов соответственно равны 1,102  и 1,146
и 1,146  . Определите объём полученного раствора и содержание в нём
. Определите объём полученного раствора и содержание в нём 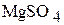 в массовых процентах. (213,8 мл; 13,9 мас.%)
в массовых процентах. (213,8 мл; 13,9 мас.%)
4. Сколько литров аммиака (объём при н.у.) необходимо растворить в 900 г воды для получения 10 мас.% раствора аммиака? Плотность раствора 0,958  . Найдите объём полученного раствора. (131,8 л; 1044 мл)
. Найдите объём полученного раствора. (131,8 л; 1044 мл)
5. Из 200 мл 8 мас.% раствора хлорида калия (плотность раствора 1,05  ) выпариванием удалили 75 г воды. Определите объём и молярную концентрацию полученного раствора, если плотность раствора равна 1,08
) выпариванием удалили 75 г воды. Определите объём и молярную концентрацию полученного раствора, если плотность раствора равна 1,08  . (125 мл; 1,80 моль/л)
. (125 мл; 1,80 моль/л)
6. Какой объём 0,8 М раствора и 4 М раствора хлорной кислоты надо взять, чтобы получить 5 л 2,8 М раствора? Плотности растворов равны, соответственно, 1,045  ; 1,230
; 1,230  и 1,160
и 1,160  . (1871 мл; 3126 мл)
. (1871 мл; 3126 мл)
Вариант 2
1. Определите массовую процентную концентрацию и мольную долю 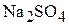 , мольное отношение, моляльность и титр водного раствора сульфата натрия, молярная концентрация которого в растворе равна 0,604 моль/л, а плотность раствора равна 1,072
, мольное отношение, моляльность и титр водного раствора сульфата натрия, молярная концентрация которого в растворе равна 0,604 моль/л, а плотность раствора равна 1,072  . (8,00 мас.%; 0,0109; 0,0110; 0,612 моль/кг; 0,0858 г/мл)
. (8,00 мас.%; 0,0109; 0,0110; 0,612 моль/кг; 0,0858 г/мл)
2. Какой объём 40 мас.% раствора 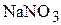 и воды надо взять для приготовления 800 мл 10 мас.% раствора нитрата натрия? Плотности растворов, соответственно, равны 1,317
и воды надо взять для приготовления 800 мл 10 мас.% раствора нитрата натрия? Плотности растворов, соответственно, равны 1,317 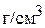 и 1,067
и 1,067  . (162 мл; 640 мл).
. (162 мл; 640 мл).
3. Сколько граммов кристаллогидрата 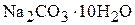 надо растворить в 1000 мл 6,9 мас.% раствора карбоната натрия, чтобы концентрация раствора стала равной 11,6 мас.%? Определите объём полученного раствора, если плотности растворов соответственно равны 1,07
надо растворить в 1000 мл 6,9 мас.% раствора карбоната натрия, чтобы концентрация раствора стала равной 11,6 мас.%? Определите объём полученного раствора, если плотности растворов соответственно равны 1,07 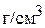 и 1,12
и 1,12  . (197,5 г; 1132 мл).
. (197,5 г; 1132 мл).
4. Какой объем хлороводорода, измеренный при нормальных условиях, необходимо растворить в 1000 г раствора соляной кислоты, содержащего 6 мас.% HCl для получения раствора, содержащего 20 мас.% HCl и имеющего плотность 1,098  ? Найдите объём полученного раствора. (107,4 л; 1070 мл)
? Найдите объём полученного раствора. (107,4 л; 1070 мл)
5. До какого объёма надо упарить 200 мл 2 М раствора едкого натра (плотность раствора 1,08  ), чтобы получить раствор, содержание NaOH в котором составляет 40 мас.%, а плотность раствора равна 1,43
), чтобы получить раствор, содержание NaOH в котором составляет 40 мас.%, а плотность раствора равна 1,43  . (28,0 мл)
. (28,0 мл)
6. До какого объёма надо разбавить водой 1,2 л концентрированной соляной кислоты (12,1 М), чтобы получить 5 М раствор? (2,904 л)
Вариант 3
1. Определите мольную долю 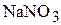 , мольное отношение, молярность, моляльность и титр водного раствора, содержание
, мольное отношение, молярность, моляльность и титр водного раствора, содержание 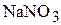 в котором составляет 35 мас.%, а плотность раствора равна 1,27
в котором составляет 35 мас.%, а плотность раствора равна 1,27 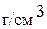 . (0,102; 0,114; 5,23 моль/л; 6,33 моль/кг; 0,445 г/мл)
. (0,102; 0,114; 5,23 моль/л; 6,33 моль/кг; 0,445 г/мл)
2. Какой объём 12 мас.% раствора 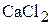 и какой объём 28 мас.% раствора
и какой объём 28 мас.% раствора 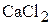 необходимо взять для приготовления 1500 мл 16 мас.% раствора? Плотности растворов соответственно равны 1,101
необходимо взять для приготовления 1500 мл 16 мас.% раствора? Плотности растворов соответственно равны 1,101  ; 1,260
; 1,260  ; 1,139
; 1,139  . (1164 мл; 339 мл)
. (1164 мл; 339 мл)
3. Сколько граммов медного купороса (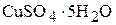 ) и воды необходимо взять для приготовления 0,5 л 0,7 М раствора
) и воды необходимо взять для приготовления 0,5 л 0,7 М раствора 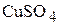 , плотность которого равна 1,105
, плотность которого равна 1,105  ? (87,5 г; 465 г)
? (87,5 г; 465 г)
4. В каком объёме воды следует растворить 20,16 л аммиака (объём измерен при н.у.), чтобы получить 12 мас.% раствор аммиака? Найдите объём полученного раствора, если его плотность равна 0,95  .
.
(112,2 мл; 134,2 мл)
5. Сколько килограммов воды следует выпарить из 500 кг 50 мас.% раствора серной кислоты, чтобы получить 95 мас.% раствор. Найдите объём полученного раствора, если его плотность равна 1,834  . (236,8 кг; 143,5 л)
. (236,8 кг; 143,5 л)
6. Смешали 2 л 2 М раствора серной кислоты (плотность раствора 1,12  ) и 3 л 7 М раствора серной кислоты (плотность раствора 1,39
) и 3 л 7 М раствора серной кислоты (плотность раствора 1,39 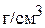 ) и получили раствор с плотностью 1,29
) и получили раствор с плотностью 1,29  . Определите объём и молярную концентрацию полученного раствора (4,969 л; 5,031 М)
. Определите объём и молярную концентрацию полученного раствора (4,969 л; 5,031 М)
Вариант 4
1. Определите массовую процентную концентрацию и мольную долю 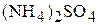 , мольное отношение, молярность и титр водного раствора сульфата аммония, если моляльность раствора равна 4,08
, мольное отношение, молярность и титр водного раствора сульфата аммония, если моляльность раствора равна 4,08 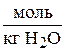 , а плотность раствора равна 1,20
, а плотность раствора равна 1,20  . (35 мас.%; 0,0684; 0,0734; 3,18 моль/л; 0,42 г/мл).
. (35 мас.%; 0,0684; 0,0734; 3,18 моль/л; 0,42 г/мл).
2. Какой объём 10 мас.% раствора хлорида кальция и воды надо взять для приготовления 500 мл 6 мас.% раствора? Плотности растворов, соответственно, равны 1,083 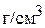 и 1,049
и 1,049 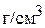 . (290,6 мл; 209,8 мл)
. (290,6 мл; 209,8 мл)
3. Сколько граммов медного купороса (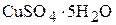 ) надо растворить в 200 г 6 мас.% раствора сульфата меди, чтобы концентрация раствора стала равна 10 мас.%? Определите объём полученного раствора, если его плотность равна 1,107
) надо растворить в 200 г 6 мас.% раствора сульфата меди, чтобы концентрация раствора стала равна 10 мас.%? Определите объём полученного раствора, если его плотность равна 1,107 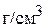 . (14,81 г; 194 мл)
. (14,81 г; 194 мл)
4. Какой объем йодоводорода, измеренный при нормальных условиях, необходимо растворить в 200 мл воды для получения раствора, содержащего 20 мас.% 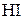 ? Найдите объём полученного раствора, если его плотность равна 1,163
? Найдите объём полученного раствора, если его плотность равна 1,163 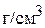 . (8,75 л; 215 мл)
. (8,75 л; 215 мл)
5. При выпаривании 400 мл 12 мас.% раствора нитрата калия (плотность раствора 1,076 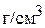 ) получили 2 М раствор нитрата калия (плотность раствора 1,118
) получили 2 М раствор нитрата калия (плотность раствора 1,118 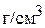 ). Определите объём полученного раствора и массу удалённой воды. (255,7 мл; 144,5 г)
). Определите объём полученного раствора и массу удалённой воды. (255,7 мл; 144,5 г)
6. До какого объёма надо разбавить водой 0,3 л концентрированного раствора едкого натра (15 М), чтобы получить 4 М раствор? (1,125 л)
Вариант 5
1. Определите массовую процентную концентрацию и мольную долю 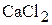 , мольное отношение, моляльность и титр водного раствора хлорида кальция, молярная концентрация которого в растворе равна 1,19 моль/л, а плотность раствора равна 1,101
, мольное отношение, моляльность и титр водного раствора хлорида кальция, молярная концентрация которого в растворе равна 1,19 моль/л, а плотность раствора равна 1,101  . (12,00 мас.%; 0,0216; 0,0221; 1,23 моль/кг; 0,132
. (12,00 мас.%; 0,0216; 0,0221; 1,23 моль/кг; 0,132  )
)
2. Какой объём 5 мас.% раствора 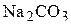 и какой объём 16 мас.% раствора
и какой объём 16 мас.% раствора 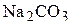 необходимо взять для приготовления 1000 мл 12,5 мас.% раствора карбоната натрия? Плотности растворов соответственно равны 1,050
необходимо взять для приготовления 1000 мл 12,5 мас.% раствора карбоната натрия? Плотности растворов соответственно равны 1,050  , 1,170
, 1,170  и 1,130
и 1,130  . (342,4 мл; 658,5 мл)
. (342,4 мл; 658,5 мл)
3. Сколько граммов 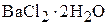 и воды необходимо взять для приготовления 243 мл раствора хлорида бария? Молярная концентрация раствора равна 0,4 моль/л, плотность раствора 1,071
и воды необходимо взять для приготовления 243 мл раствора хлорида бария? Молярная концентрация раствора равна 0,4 моль/л, плотность раствора 1,071  . (23,7 г; 236,6 мл)
. (23,7 г; 236,6 мл)
4. В каком объёме 12 мас.% раствора аммиака следует растворить 15,68 л аммиака (объём измерен при н.у.), чтобы получить 24 мас.% раствор? Найдите объём полученного раствора. Плотности 12 мас.% и 24 мас.% раствора соответственно равны 0,95  и 0,91
и 0,91  . (79,3 мл; 95,9 мл)
. (79,3 мл; 95,9 мл)
5. До какого объёма надо упарить 300 мл 8 мас.% раствор нитрата натрия (плотность раствора 1,053  ), чтобы получить 2 М раствор
), чтобы получить 2 М раствор 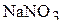 ? Определите массу удалённой воды, если плотность полученного раствора равна 1,105
? Определите массу удалённой воды, если плотность полученного раствора равна 1,105  . (148,7 мл; 151,6 г)
. (148,7 мл; 151,6 г)
6. Смешали 3 л 2 М раствора едкого натра (плотность раствора 1,080  ) и 4 л 10 М раствора (плотность раствора 1,330
) и 4 л 10 М раствора (плотность раствора 1,330 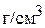 ) и получили раствор с плотностью 1,235
) и получили раствор с плотностью 1,235  . Определите объём и молярную концентрацию полученного раствора. (6,931 л; 6,637 моль/л)
. Определите объём и молярную концентрацию полученного раствора. (6,931 л; 6,637 моль/л)
5. РЕАКЦИИ ОКИСЛЕНИЯ−ВОССТАНОВЛЕНИЯ
Пример 1. Напишите уравнения межмолекулярных реакций окисления-восстановления и определите факторы эквивалентности окислителей и восстановителей в том случае, если они не являются одновременно и веществом-средой:
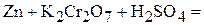
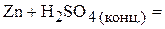
Решение. Классификация окислительно-восстановительных реакций основана на различии взаимного положения атома восстановителя и атома окислителя. В случае межмолекулярной реакции окислитель и восстановитель находятся в разных молекулах разных веществ.
Реакции должны быть уравнены методом подстрочного электронного баланса:
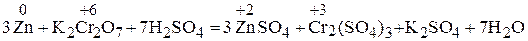 .
.
−2 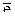 +2·3
+2·3 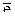
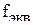 в окислительно-восстановительной реакции определяется как
в окислительно-восстановительной реакции определяется как 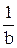 , где b – число принятых или отданных электронов одной молекулой вещества.
, где b – число принятых или отданных электронов одной молекулой вещества.
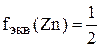 ,
,
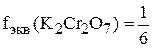 .
.
Во второй реакции серная кислота является одновременно окислителем и средой, в которой протекает реакция. Поэтому ради наглядности и удобства уравнивания целесообразно записать 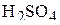 дважды:
дважды:
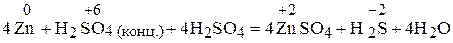 ,
,
−2  +8
+8 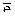
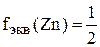 .
.
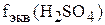 не определяем в соответствии с условием задачи
не определяем в соответствии с условием задачи
Пример 2. Напишите уравнение реакции внутримолекулярного окисления-восстановления
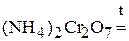
Решение. При внутримолекулярных реакциях происходит изменение степени окисления атомов в одной и той же молекуле. При этом окислитель и восстановитель имеют разные степени окисления. Обычно это реакции термического разложения веществ.
При подборе стехиометрических коэффициентов в таких реакциях удобно их рассматривать как бы протекающими в обратном направлении (т.е. справа налево) и расставлять коэффициенты как в межмолекулярной реакции.
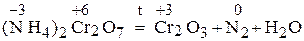 .
.
−2·3  +2·3
+2·3 
 2020-09-24
2020-09-24 2975
2975








