К. К. Власенко, А. Я. Дупал, С. Н. Соловьёв
ДОМАШНИЕ ЗАДАНИЯ ПО ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
ЧАСТЬ I ТЕМАТИЧЕСКИЕ ЗАДАНИЯ
Москва 2015
Министерство образования и науки Российской Федерации
Российский химико-технологический университет им. Д. И. Менделеева
К. К. Власенко, А. Я. Дупал, С. Н. Соловьёв
ДОМАШНИЕ ЗАДАНИЯ ПО ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
ЧАСТЬ I ТЕМАТИЧЕСКИЕ ЗАДАНИЯ
Допущено Учебно-методическим объединением по образованию в области химической технологии и биотехнологии в качестве учебного пособия для студентов вузов, обучающихся по химико-технологическим направлениям
Москва
2015
УДК 546 (075)
ББК 24.1я7
В58
Рецензенты:
Кандидат химических наук, доцент, заведующий кафедрой
неорганической и аналитической химии Московской
сельско-хозяйственной академии им. К. А. Тимирязева
С. Н. Смарыгин
Доктор химических наук, профессор кафедры физической химии Российского химико-технологического университета им. Д. И. Менделеева
А. В. Вишняков
Власенко К.К./Учебное пособие в 2-х частях /К.К.Власенко,
B58 А.Я.Дупал, С.Н.Соловьев. Домашние задания по общей и
неорганической химии: Часть I. Тематические задания – М: РХТУ
им. Д.И.Менделеева, 2015 – 181 с.
ISBN 978-5-7237-1325-3
ISBN 978-5-7237-1326-0(4.1)
В пособии приведены домашние задания по курсу «Общая и неорганическая химия», систематизированные по основным темам дисциплины; подробно разобран один вариант задания в каждой теме.
Пособие предназначено студентам 1-го курса РХТУ им. Д.И.Менделеева, может быть использовано при работе с учащимися школ с углубленным изучением химии.
УДК 546 (075)
ББК 24.1я7
ISBN 978-5-7237-1326-0(4.1) © Российский химико-технологический
ISBN 978-5-7237-1325-3 университет им. Д. И. Менделеева, 2015
© Власенко К. К., Дупал А. Я.,
Соловьёв С. Н., 2015
ВВЕДЕНИЕ
Эта рукопись является первой частью учебного пособия, призванного объединить домашние задания по курсам химии, читаемым студентам I курса РХТУ им. Д. И. Менделеева, а также задания к индивидуальной домашней работе и справочный материал по термодинамическим характеристикам веществ.
Первая часть содержит домашние задания по курсу «Общая и неорганическая химия». Для каждой темы домашних заданий составлено 5 вариантов по 6 заданий, один вариант заданий подробно разобран в качестве примера.
При написании пособия авторы, все являющиеся преподавателями РХТУ им. Д. И. Менделеева, основывались на опыте проведения занятий со студентами I курса РХТУ им. Д. И. Менделеева.
Авторы с благодарностью воспримут замечания и пожелания, что позволит в дальнейшем улучшить содержание учебного пособия.
1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ. СТЕХИОМЕТРИЧЕСКИЕ РАСЧЁТЫ НА ОСНОВЕ ХИМИЧЕСКИХ ФОРМУЛ
Пример 1. Определите абсолютную массу молекулы азота.
Решение. В одном моле содержится число Авогадро (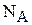 ) частиц
) частиц 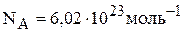 .
.
Молярная масса молекулярного азота ( ) равна 28 г/моль. Тогда, абсолютная масса азота:
) равна 28 г/моль. Тогда, абсолютная масса азота:
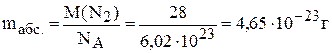 .
.
Пример 2. Сколько молекул, атомов и электронов содержится в 3 г этана?
Решение. Молекулярная масса этана (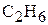 ) равна 30 г/моль. Число моль этана:
) равна 30 г/моль. Число моль этана:
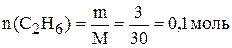 .
.
Количество молекул 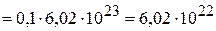 .
.
Одна молекула этана содержит 8 атомов, следовательно, количество атомов будет равно:
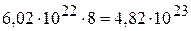 .
.
Наконец, найдём количество электронов. В атоме углерода 6 электронов, в атоме водорода 1 электрон. Значит в молекуле этана будет
 .
.
Тогда в 3 г этана будет
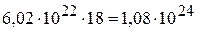 электронов.
электронов.
Пример 3. Вычислите при нормальных условиях (н.у.) плотность углекислого газа и его относительные плотности по водороду и воздуху.
Решение. Согласно закону Авогадро в равных объёмах различных газов при одинаковых условиях (T, P) содержится одинаковое количество молекул. Отсюда следует, что 1 моль молекул любого газа занимает одинаковый объём при одних и тех же условиях. При нормальных условиях (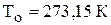 и
и  ) этот объём равен 22,4 л.
) этот объём равен 22,4 л.
Находим плотность 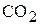 при н.у.
при н.у.
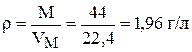 .
.
Плотность по водороду
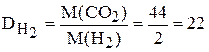 .
.
Плотность по воздуху
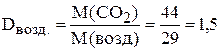 .
.
Средняя молярная масса воздуха вычислена исходя из того, что воздух состоит приблизительно из 4 объёмов азота и 1 объёма кислорода
 .
.
Пример 4. Определите мольный процентный состав газовой смеси, состоящей из оксида углерода(II) и оксида углерода(IV), если 7,7 г её при давлении 200 кПа и температуре 300 К занимает объём 3 л.
Решение. Из уравнения Менделеева–Клапейрона определяем среднюю молекулярную массу смеси. Пользуемся системой единиц СИ:
 .
.
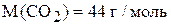 ,
, 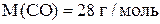 .
.
Примем содержание  за x, тогда содержание
за x, тогда содержание  в газовой смеси равно
в газовой смеси равно  мольных процента
мольных процента
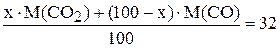 ,
,
 ,
,
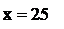
Следовательно, состав газовой смеси: 25 мол.%  и 75 мол.%
и 75 мол.% 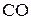 .
.
Пример 5. Определите молекулярную формулу вещества, состоящего из 90,45 мас.% углерода и 9,55 мас.% водорода, если плотность паров этого вещества по кислороду равна 3,31.
Решение. Искомая формула  . Пусть мы имеем 100 г этого вещества. Тогда
. Пусть мы имеем 100 г этого вещества. Тогда 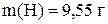 и
и  .
.
 ,
,
 ,
,
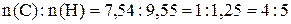 .
.
Следовательно, простейшая формула вещества будет 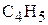 .
.
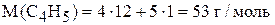 ,
,
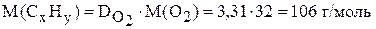 ,
,
 .
.
Тогда истинная формула соединения будет 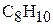 .
.
Пример 6. При полном сгорании навески органического вещества массой 6 г получено при н.у. 6,72 л  и 7,2 г
и 7,2 г 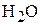 . Определите молекулярную формулу вещества, если в газообразном состоянии 1 л (приведено к н.у.) этого вещества имеет массу 2,68 г.
. Определите молекулярную формулу вещества, если в газообразном состоянии 1 л (приведено к н.у.) этого вещества имеет массу 2,68 г.
Решение. Вещество содержит углерод, водород и, возможно, кислород. Искомая формула  .
.
Находим содержание в навеске углерода:
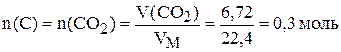 ,
,
 .
.
Находим содержание в навеске водорода:
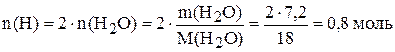 ,
,
 .
.
Находим содержание в навеске кислорода:
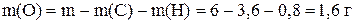 ,
,
 .
.
Определяем простейшую формулу
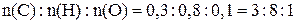 ,
,
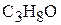
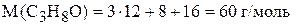 ,
,
 .
.
Следовательно, истинная формула также будет  .
.
Вариант 1
1. Определите абсолютную массу молекулы кислорода. ( )
)
2. Сколько молекул, атомов и электронов содержится в 1 г воды? ( )
)
3. Вычислите при нормальных условиях плотность кислорода и его относительные плотности по азоту и воздуху. (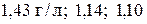 )
)
4. Определите мольный процентный состав газовой смеси, состоящей из азота и кислорода, если 5 г её при давлении 100 кПа и температуре 250 К занимает объём 3,35 л. (75 % 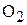 и 25 %
и 25 %  )
)
5. Соединение, состоящее из азота и углерода, содержит 53,8 мас.% азота. Относительная плотность его по воздуху равна 1,79. Определите молекулярную формулу соединения. (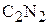 )
)
6. При сжатии 0,48 г соединении, состоящего из азота и водорода, получено 0,54 г воды и 336 мл (н.у.) азота. Масса 1 л (н.у.) паров этого соединения составляет 1,492 г. Определите молекулярную формулу соединения. (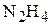 )
)
Вариант 2
1. Какой объём при н.у. занимает  молекул монооксида углерода? (1,12 л)
молекул монооксида углерода? (1,12 л)
2. Сколько молекул, атомов и электронов содержится в 11 г диоксида углерода? (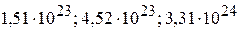 )
)
3. Вычислите при нормальных условиях плотность монооксида углерода и его относительные плотности по водороду и азоту. (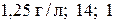 )
)
4. Определите мольный процентный состав газовой смеси, состоящей из метана и этана, если 20 г её при давлении 150 кПа и температуре 275 К занимает объём 10,88 л. ( )
)
5. Соединение, состоящее из углерода, водорода и кислорода, содержит 54,50 мас.% углерода и 36,34 мас.% кислорода. Относительная плотность его по водороду равна 44. Определите молекулярную формулу соединения. ( )
)
6. При сжигании 5,60 г углеводорода получено 7,20 г 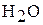 и 8,96 л
и 8,96 л  (объём измерен при н.у.). Масса 1 л (н.у.) углеводорода составляет 1,251 г. Определите молекулярную формулу соединения. (
(объём измерен при н.у.). Масса 1 л (н.у.) углеводорода составляет 1,251 г. Определите молекулярную формулу соединения. ( )
)
Вариант 3
1. Какой объём (при н.у.) занимают  молекул аммиака? (33,6 л)
молекул аммиака? (33,6 л)
2. Сколько молекул, сколько атомов и сколько электронов содержится в 0,02 моль аммиака? (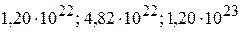 )
)
3. Вычислите при нормальных условиях плотность аммиака и его относительные плотности по метану и воздуху. ( )
)
4. Определите мольный процентный состав газовой смеси, состоящей из пропана и бутана если 30 г её при давлении 100 кПа и температуре 300 К занимает объём 14,66 л ( )
)
5. Соединение углерода с водородом содержит 92,31 мас.% углерода. Относительная плотность его паров по воздуху равна 2,69. Определите молекулярную формулу соединения. (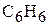 )
)
6. При сжигании 8,80 г альдегида образовалось 17,60 г  и 7,20 г
и 7,20 г  . Плотность его паров при н.у. равна 1,96 г/л. Определите молекулярную формулу альдегида. (
. Плотность его паров при н.у. равна 1,96 г/л. Определите молекулярную формулу альдегида. (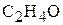 )
)
Вариант 4
1. Определите абсолютную массу молекулы метана. (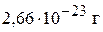 )
)
2. Сколько молекул, сколько атомов и сколько электронов содержится при нормальных условиях в 1 л метана? ( )
)
3. Вычислите при нормальных условиях плотность метана и его относительные плотности по водороду и хлору. (0,714 г/л; 8; 0,225)
4. Определите мольный процентный состав газовой смеси, состоящей из хлора и кислорода, если 10 г её при давлении 50 кПа и температуре 300 К занимает объём 11,08 л. (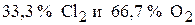 )
)
5. Соединение, состоящее из углерода и водорода, содержит 80 мас.% углерода. Относительная плотность его по кислороду равна 0,9375. Определите молекулярную формулу соединения. ( )
)
6. При сгорании 4,8 г органического соединения образовалось 3,36 л (н.у.) 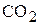 и 5,4 г
и 5,4 г 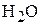 . Относительная плотность паров этого вещества по метану равна 2. Определите молекулярную формулу соединения. (
. Относительная плотность паров этого вещества по метану равна 2. Определите молекулярную формулу соединения. (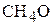 )
)
Вариант 5
1. Какой объём занимают при н.у. 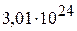 молекул этилена? (112 л)
молекул этилена? (112 л)
2. Сколько молекул, сколько атомов и сколько протонов содержится в 2,8 г этилена? (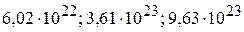 )
)
3. Вычислите при нормальных условиях плотность этилена и его относительные плотности по водороду и кислороду. (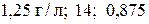 )
)
4. Определите мольный процентный состав газовой смеси, состоящей из метана и водорода, если 5 г её при давлении 120 кПа и температуре 200 К занимает объём 12,59 л. (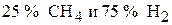 )
)
5. Соединение содержит 24,24 мас.% углерода, 71,72 мас.% хлора и 4,04 мас.% водорода. Относительная плотность соединения по воздуху равна 3,414. Определите молекулярную формулу соединения. (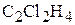 )
)
6. При сжигании 1,40 г соединения образовалось 2,24 л (н.у.) 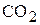 и 1,80 г
и 1,80 г 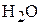 . Плотность этого соединения при н.у. составляет 1,875 г/л. Определите молекулярную формулу соединении. (
. Плотность этого соединения при н.у. составляет 1,875 г/л. Определите молекулярную формулу соединении. ( )
)
2. СТЕХИОМЕТРИЧЕСКИЕ РАСЧЁТЫ НА ОСНОВЕ ХИМИЧЕСКИХ УРАВНЕНИЙ
Пример 1. Определите формулу кристаллогидрата карбоната натрия, если после обезвоживания его масса уменьшилась на 62,9 %.
Решение. При обезвоживании протекает процесс:
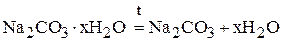 .
.
Пусть масса кристаллогидрата 100 г, тогда остаётся 37,1 г 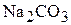 и испарится 62,9 г
и испарится 62,9 г 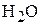 .
.
 ,
,
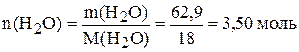 .
.
Формула кристаллогидрата  .
.
Пример 2. Определите при 20 оС и давлении 100 кПа объём водорода, выделяющегося при взаимодействии 10 г цинка с избытком соляной кислоты.
Решение.
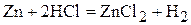 ,
,
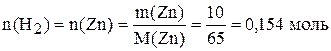 .
.
Используя уравнение Менделеева–Клапейрона найдём объём водорода:
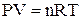 ,
,
 .
.
Пример 3. Сколько молей соли образуется при взаимодействии 4 моль углекислого газа и 168 г оксида кальция?
Решение.
 ,
,
 .
.
По уравнению реакции 1 моль 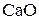 реагирует с 1 моль
реагирует с 1 моль 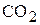 , и в результате получается 1 моль соли. Очевидно, что углекислый газ взят в избытке, расчёт будем вести по веществу в недостатке, т.е. по оксиду кальция.
, и в результате получается 1 моль соли. Очевидно, что углекислый газ взят в избытке, расчёт будем вести по веществу в недостатке, т.е. по оксиду кальция.
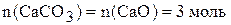 .
.
Пример 4. Сколько килограммов цинка можно получить из 100 кг минерала сфалерита (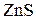 ), имеющего 40 мас.% не содержащих цинк примесей.
), имеющего 40 мас.% не содержащих цинк примесей.
Решение. Содержание 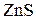 в минерале будет 60 мас.%.
в минерале будет 60 мас.%.
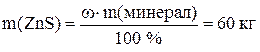 .
.
Из 1 моля 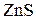 можно получить 1 моль
можно получить 1 моль 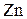 .
.
 ,
,
 .
.
Пример 5. Сколько граммов бертолетовой соли (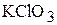 ) надо взять для получения 1 л (объём при н.у.) кислорода, если выход реакции составляет 75 % от теоретически возможного?
) надо взять для получения 1 л (объём при н.у.) кислорода, если выход реакции составляет 75 % от теоретически возможного?
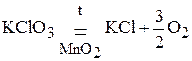 .
.
Решение. Если бы выход был 100 % (теоретически возможный), то было бы получено
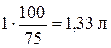 ,
,
 .
.
По реакции 1 моль 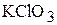 даёт 1,5 моля кислорода.
даёт 1,5 моля кислорода.
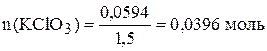 ,
,
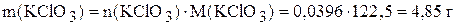 .
.
Пример 6. Определите состав смеси алюминия и железа, если при действии избытка соляной кислоты на 16 г смеси выделилось 9,6 л водорода (объём при н.у.).
Решение. Составим уравнения протекающих реакций
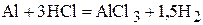 ,
,
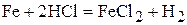 .
.
Примем за х массу алюминия в смеси, тогда масса железа составит (16–х). В соответствии с уравнениями реакций выразим объём выделяющегося водорода. По первой реакции:
 .
.
По второй реакции:
 .
.
Суммарный объём выделившегося водорода равен 9,6 л.
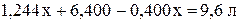 ,
,
 .
.
Масса алюминия 3,79 г, масса железа 12,21 г.
Вариант 1
1. Определите формулу кристаллогидрата, если после обезвоживания 20,30 г его осталось 9,50 г  . (
. ( )
)
2. Определите при 25 оС и 68 кПа объём водорода, выделяющегося при взаимодействии 10 г магния с избытком соляной кислоты. (15,2 л)
3. Сколько граммов оксида серы образуется при взаимодействии 5 моль кислорода и 200 г серы? (320 г)
4. Сколько килограммов кадмия можно получить из 100 кг гринокита (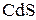 ), имеющего 30 мас.% не содержащих кадмий примесей? (54,4 кг)
), имеющего 30 мас.% не содержащих кадмий примесей? (54,4 кг)
5. Сколько молей оксида серы(IV) можно получить из 1029 г пирита (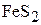 ), если выход по реакции составляет 70 % от теоретически возможного? (12,00 моль)
), если выход по реакции составляет 70 % от теоретически возможного? (12,00 моль)
6. Определите состав сплава магния и алюминия, если при действии избытка соляной кислоты на 1 г сплава выделилось 1,2 л водорода (объём измерен при н.у.). (0,143 г 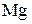 ; 0,857 г
; 0,857 г 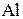 )
)
Вариант 2
1. Определите формулу кристаллогидрата сульфата никеля, если после обезвоживания его масса уменьшилась на 44,8 %. (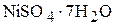 )
)
2. Определите при 15 оС и давлении 115 кПа объём водорода, выделяющегося при взаимодействии 1 г железа с избытком раствора серной кислоты. (0,372 л)
3. Сколько молей оксида алюминия может быть получено при взаимодействии 54 г алюминия и 54 г кислорода? (0,1 моль)
4. Сколько килограммов железа можно получить из 200 кг пирита (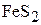 ), имеющего 20 мас.% не содержащих железо примесей? (74,7 кг)
), имеющего 20 мас.% не содержащих железо примесей? (74,7 кг)
5. Сколько молей оксида углерода(IV) можно получить из 1067 г карбоната кальция, если выход по реакции составляет 75 % от теоретически возможного? (8,00 моль)
6. Определите состав смеси магния, цинка и меди, если при действии избытка разбавленного раствора серной кислоты на 10 г сплава выделилось 3,14 л водорода (объём измерен при н.у.), а масса нерастворившегося остатка составила 5 г. (2,41 г 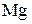 ).
).
Вариант 3
1. Определите формулу кристаллогидрата сульфата меди, если в результате обезвоживания 12,5 г его получено 4,5 г воды. (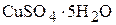 )
)
2. Сколько граммов железа надо привести в соприкосновение с избытком раствора серной кислоты, чтобы при 22 оС и давлении 100 кПа выделилось 5 л газа? (11,4 г)
3. Сколько граммов гидроксида натрия образуется при взаимодействии 222 г гидроксида кальция и 212 г карбоната натрия? (160 г)
4. Сколько килограммов меди можно получить из 200 кг халькопирита (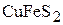 ), имеющего 15 мас.% не содержащих медь примесей? (59,1 кг)
), имеющего 15 мас.% не содержащих медь примесей? (59,1 кг)
5. Сколько молей сульфата алюминия можно получить из 480 г оксида алюминия, если выход по реакции составляет 85 % от теоретически возможного? (4,00 моль)
6. Определите состав смеси цинка и железа, если после обработки 5 г смеси избытком хлора масса стала больше в 2,5 раза. (2,48 г 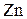 ; 2,52 г
; 2,52 г 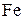 )
)
Вариант 4
1. Определите формулу кристаллогидрата бромата неодима, если после обезвоживания его масса уменьшилась на 23,48 %. (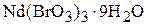 )
)
2. Сколько граммов магния надо привести в соприкосновение с избытком соляной кислоты, чтобы при 30 оС и давлении 105 кПа выделилось 3 л газа? (3,00 г)
3. Сколько граммов хлорида железа может быть получено из 2,8 г железа и 2,24 л (объём измерен при н.у.) хлора? (8,13 г)
4. Сколько килограммов хрома можно получить из 150 кг хромистого железняка  , имеющего 30 мас.% не содержащих хром примесей? (48,7 кг)
, имеющего 30 мас.% не содержащих хром примесей? (48,7 кг)
5. Сколько граммов 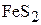 надо взять для получения 1 л (объём измерен при н.у.) оксида серы(IV), если выход реакции составляет 90 % от теоретически возможного? (2,98 г)
надо взять для получения 1 л (объём измерен при н.у.) оксида серы(IV), если выход реакции составляет 90 % от теоретически возможного? (2,98 г)
6. При обработке 5 г смеси алюминия и цинка избытком разбавленной серной кислоты выделилось 4,48 л водорода (объём измерен при н.у.). Определите состав смеси в мас.%. (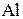 61,3 %;
61,3 %; 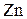 38,7 %)
38,7 %)
 2020-09-24
2020-09-24 2704
2704







