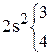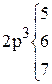Пример 3. Напишите уравнение реакции диспропорционирования
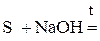
Решение. Реакции диспропорционирования протекают с одновремен-ным уменьшением и увеличением степени окисления атомов одного и того же элемента. Поэтому такие реакции ещё называют реакциями самоокисления-самовосстановления. Реакции диспропорционирования возможны лишь в том случае, если в молекулах соединения есть атом, находящийся в промежуточной степени окисления между минимально и максимально возможной.
Так, степень окисления серы может меняться от −2 (например, 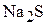 ) до +6 (например,
) до +6 (например, 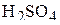 ).
).
При подборе стехиометрических коэффициентов в таких реакциях также удобно рассматривать их как бы протекающими в обратном направлении.
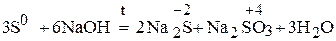 .
.
−2 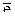 +4
+4 
Отметим, что известны и реакции контрдиспропорционирования, являющиеся разновидностью либо межмолекулярных реакций окисления-восстановления, например:
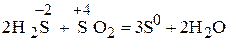 ,
,
−2 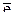 +4
+4 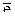
либо внутримолекулярных реакций окисления-восстановления, например:
 .
.
Пример 4. Сколько граммов перманганата калия необходимо взять для приготовления 200 мл 0,1 н раствора, используемого в окислительно- восстановительной реакции в кислой среде?
Решение. В кислой среде  восстанавливается до иона
восстанавливается до иона 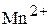 . Фактор эквивалентности, соответственно, у него равен
. Фактор эквивалентности, соответственно, у него равен 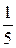 . Нормальная концентрация (нормальность) показывает, сколько молей эквивалентов растворённого вещества содержится в 1 л раствора.
. Нормальная концентрация (нормальность) показывает, сколько молей эквивалентов растворённого вещества содержится в 1 л раствора.
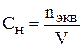 (V – в литрах).
(V – в литрах).
Тогда,
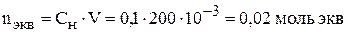 .
.
С другой стороны,
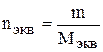
или
 ,
,
 .
.
Пример 5. Определите титр и нормальную концентрацию 0,06 М раствора 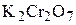 , используемого в реакции
, используемого в реакции
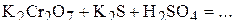
Решение. Молярная и нормальная концентрации связаны друг с другом через фактор эквивалентности
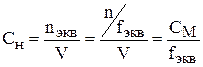 .
.
Нормальная концентрация не может быть меньше молярной концентрации, так как 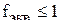 .
.
В реакции  будет восстанавливаться до
будет восстанавливаться до  . Одна молекула при этом принимает 2·3=6 электронов (в молекуле два атома хрома, каждый из которых принимает два электрона).
. Одна молекула при этом принимает 2·3=6 электронов (в молекуле два атома хрома, каждый из которых принимает два электрона).
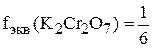 ,
,
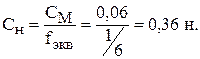
Определим титр раствора:
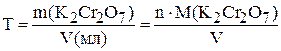 .
.
Возьмём 1 литр раствора, тогда
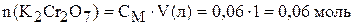 ,
,
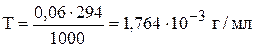 .
.
Пример 6. Какой объём 0,5 н раствора 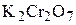 потребуется на окисление в кислой среде всего
потребуется на окисление в кислой среде всего 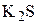 , содержащегося в 100 мл 0,2 M его раствора? Сколько граммов серы может быть получено в результате реакции? Задачу решить с использованием закона эквивалентов.
, содержащегося в 100 мл 0,2 M его раствора? Сколько граммов серы может быть получено в результате реакции? Задачу решить с использованием закона эквивалентов.
Решение.

При решении задачи по закону эквивалентов нет необходимости дописывать и уравнивать реакцию.
Закон эквивалентов: вещества вступают в реакцию и получаются в результате реакции в эквивалентных количествах.
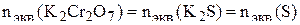 .
.
Дихромат калия и сульфид калия реагируют, находясь в растворах.
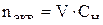 ,
,
где V – объём раствора вещества в литрах, 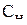 – нормальная концентрация растворённого вещества.
– нормальная концентрация растворённого вещества.
В таком случае закон эквивалентов можно записать следующим образом:
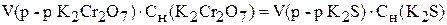 .
.
Найдём  :
:
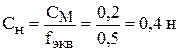 .
.
Тогда
 .
.
Найдём массу серы:
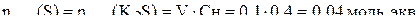 .
.
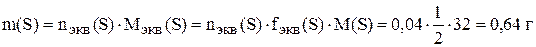 .
.
Вариант 1
1. Напишите уравнения межмолекулярных реакций окисления-восстановления и определите факторы эквивалентности окислителей и восстановителей в том случае, если они не являются одновременно веществом-средой.
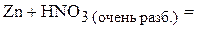

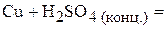

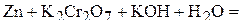

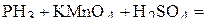

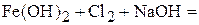
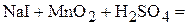


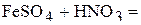

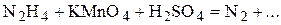
2. Напишите уравнения реакций внутримолекулярного окисления-восстановления.
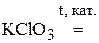
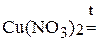

3. Напишите уравнения реакций диспропорционирования.
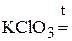
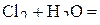
4. Сколько граммов перманганата калия надо взять для приготовления 500 мл 0,4 н раствора, используемого в окислительно-восстановительной реакции в щелочной среде? (31,6 г)
5. Определите титр и нормальную концентрацию 0,3 М раствора 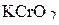 , используемого в окислительно-восстановительной реакции в качестве восстановителя. (0,0369
, используемого в окислительно-восстановительной реакции в качестве восстановителя. (0,0369 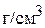 ; 0,9 н)
; 0,9 н)
6. Какой объём 0,2 М раствора 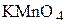 потребуется на окисление в кислой среде всего
потребуется на окисление в кислой среде всего 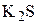 , содержащегося в 200 мл 0,2 н его раствора? Сколько граммов серы может быть получено в результате реакции? Задачу решите по закону эквивалентов. (40 мл; 0,64 г)
, содержащегося в 200 мл 0,2 н его раствора? Сколько граммов серы может быть получено в результате реакции? Задачу решите по закону эквивалентов. (40 мл; 0,64 г)
Вариант 2
1. Напишите уравнения межмолекулярных реакций окисления-восстановления и определите факторы эквивалентности окислителей и восстановителей в том случае, если они не являются одновременно веществом-средой.

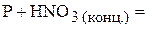
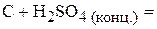
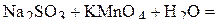
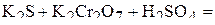
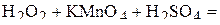
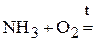
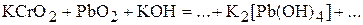


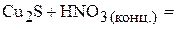

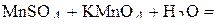
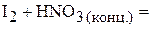
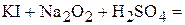
2. Напишите уравнения реакций внутримолекулярного окисления-восстановления.


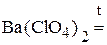
3. Напишите уравнения реакций диспропорционирования.
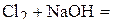
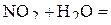
4. Сколько граммов перманганата калия надо взять для приготовления 250 мл 0,3 н раствора, используемого в окислительно-восстановительной реакции в нейтральной среде? (3,95 г)
5. Определите титр и нормальную концентрацию 0,1 М раствора 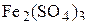 , восстанавливающегося в результате реакции до
, восстанавливающегося в результате реакции до  . (0,040
. (0,040 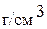 ; 0,2 н)
; 0,2 н)
6. Какой объём 0,15 н раствора 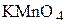 необходим для окисления в щелочной среде 100 мл 0,2 М раствора перекиси водорода? Какой объём газа (объём измерен при н.у.) может быть получен в результате реакции? Задачу решите по закону эквивалентов. (266,7 мл; 448 мл)
необходим для окисления в щелочной среде 100 мл 0,2 М раствора перекиси водорода? Какой объём газа (объём измерен при н.у.) может быть получен в результате реакции? Задачу решите по закону эквивалентов. (266,7 мл; 448 мл)
Вариант 3
1. Напишите уравнения межмолекулярных реакций окисления-восстановления и определите факторы эквивалентности окислителей и восстановителей в том случае, если они не являются одновременно веществом-средой.


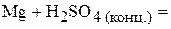

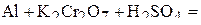

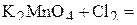
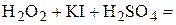
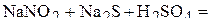
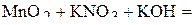


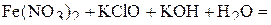
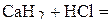

2. Напишите уравнения реакций внутримолекулярного окисления-восстановления.
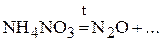
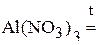
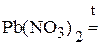
3. Напишите уравнения реакций диспропорционирования.
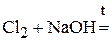

4. Сколько граммов дихромата калия надо взять для приготовления 1500 мл 0,6 н раствора, используемого в окислительно-восстановительной реакции в кислой среде? (44,1 г)
5. Определите титр и нормальную концентрацию 0,1 М раствора 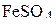 , окисляющегося в результате реакции до
, окисляющегося в результате реакции до 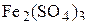 . (0,0152
. (0,0152 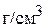 ; 0,1 н)
; 0,1 н)
6. Какой объём 0,3 М раствора 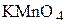 потребуется на окисление в нейтральной среде всего
потребуется на окисление в нейтральной среде всего 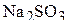 , содержащегося в 800 мл 0,1 н его раствора? Сколько граммов осадка может быть получено в результате реакции? Задачу решите по закону эквивалентов. (88,9 мл; 2,32 г)
, содержащегося в 800 мл 0,1 н его раствора? Сколько граммов осадка может быть получено в результате реакции? Задачу решите по закону эквивалентов. (88,9 мл; 2,32 г)
Вариант 4
1. Напишите уравнения межмолекулярных реакций окисления-восстановления и определите факторы эквивалентности окислителей и восстановителей в том случае, если они не являются одновременно веществом-средой.

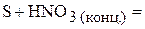

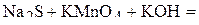

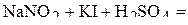
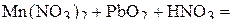

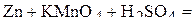


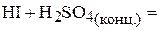
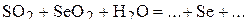
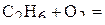

2. Напишите уравнения реакций внутримолекулярного окисления-восстановления.
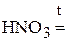
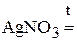
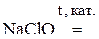
3. Напишите уравнения реакций диспропорционирования.
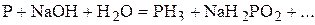
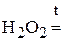
4. Какой объём 0,3 н раствора бромата калия можно приготовить из 10 г  для проведения окислительно-восстановительной реакции в кислой среде, в которой
для проведения окислительно-восстановительной реакции в кислой среде, в которой  будет восстановлен до
будет восстановлен до 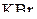 ? (1198 мл)
? (1198 мл)
5. Определите титр и нормальную концентрацию 0,2 М раствора 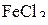 , восстанавливающегося в результате реакции до железа. (0,0325
, восстанавливающегося в результате реакции до железа. (0,0325  ; 0,6 н)
; 0,6 н)
6. Какой объём 0,25 М раствора 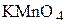 потребуется на окисления в щелочной среде всего
потребуется на окисления в щелочной среде всего 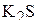 , содержащегося в 100 мл 0,5 н его раствора? Сколько граммов серы может быть получено в результате реакции? Задачу решите с использованием закона эквивалентов. (200 мл; 0,80 г)
, содержащегося в 100 мл 0,5 н его раствора? Сколько граммов серы может быть получено в результате реакции? Задачу решите с использованием закона эквивалентов. (200 мл; 0,80 г)
Вариант 5
1. Напишите уравнения межмолекулярных реакций окисления-восстановления и определите факторы эквивалентности окислителей и восстановителей в том случае, если они не являются одновременно веществом-средой.
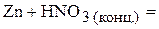
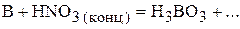
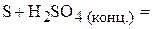


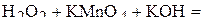

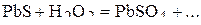

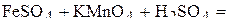
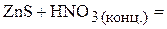
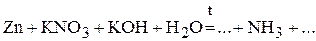

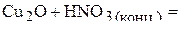
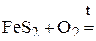
2. Напишите уравнения реакций внутримолекулярного окисления-восстановления.
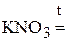
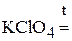
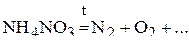
3. Напишите уравнения реакций диспропорционирования.


4. Сколько граммов бромата калия необходимо взять для приготовления 500 мл 0,1 н раствора  , если в окислительно-восстановительной реакции он восстанавливается до
, если в окислительно-восстановительной реакции он восстанавливается до 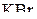 ? (1,39 г)
? (1,39 г)
5. Определите титр и молярную концентрацию 0,1 н раствора  , используемого в окислительно-восстановительной реакции в кислой среде. (
, используемого в окислительно-восстановительной реакции в кислой среде. (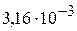
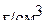 ; 0,02 М)
; 0,02 М)
6. Какой объём 0,4 М раствора  потребуется на окисления в кислой среде всего
потребуется на окисления в кислой среде всего 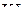 , содержащегося в 2,5 л 0,5 н его раствора? Определите массу выделившегося йода. Задачу решите с использованием закона эквивалентов. (625 мл; 158,8 г)
, содержащегося в 2,5 л 0,5 н его раствора? Определите массу выделившегося йода. Задачу решите с использованием закона эквивалентов. (625 мл; 158,8 г)
6. КВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНОВ В АТОМЕ. ЭЛЕКТРОННЫЕ ФОРМУЛЫ АТОМОВ И ИОНОВ
Пример 1. Какую электронную формулу имеет атом водорода? Какие значения квантовых чисел 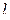 ,
,  и
и 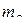 возможны для электрона атома водорода в основном состоянии? Если электрон в атоме водорода находится в состоянии с n = 2 (возбуждённое состояние), какие значения квантовых чисел
возможны для электрона атома водорода в основном состоянии? Если электрон в атоме водорода находится в состоянии с n = 2 (возбуждённое состояние), какие значения квантовых чисел 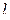 ,
, 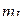 и
и 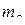 возможны для этого электрона?
возможны для этого электрона?
Ответ. В принципе, атом водорода может иметь любую электронную конфигурацию, т.е. 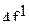 ,
, 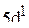 ,
, 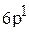 ,
, 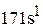 , которые отвечают возбуждённому состоянию атома водорода. Эти электронные конфигурации прежде всего определяются температурой. В связи с тем, что на нашей планете средняя годовая температура незначительно отличается от 300 К, атомы на ней находятся в невозбуждённом (основном) состоянии, поэтому электронная формула атомов водорода на планете Земля –
, которые отвечают возбуждённому состоянию атома водорода. Эти электронные конфигурации прежде всего определяются температурой. В связи с тем, что на нашей планете средняя годовая температура незначительно отличается от 300 К, атомы на ней находятся в невозбуждённом (основном) состоянии, поэтому электронная формула атомов водорода на планете Земля – 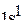 .
.
Это означает, что электрон атома водорода характеризуется значением главного квантового числа n = 1, при этом побочное квантовое число 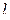 = 0, магнитное квантовое число
= 0, магнитное квантовое число 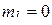 , а магнитное спиновое квантовое число
, а магнитное спиновое квантовое число 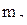 может принимать значения
может принимать значения 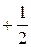 и
и 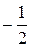 .
.
При n = 2, 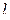 может принимать два значения: 0 и 1;
может принимать два значения: 0 и 1; 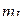 – четыре значения: 0, +1, 0, –1;
– четыре значения: 0, +1, 0, –1; 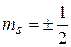 . Следовательно, для электрона с n = 2 возможен один из следующих восьми наборов квантовых чисел:
. Следовательно, для электрона с n = 2 возможен один из следующих восьми наборов квантовых чисел:
| n | 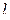 | 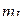 | 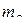 | |
| 1) | 2 | 0 | 0 | 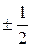 |
| 2) | 2 | 1 | +1 | 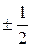 |
| 3) | 2 | 1 | 0 | 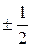 |
| 4) | 2 | 1 | –1 | 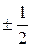 |
Пример 2. Охарактеризуйте квантовыми числами электроны атома азота в основном состоянии.
Ответ. Атом азота содержит семь электронов. Учитывая принцип Паули и правила Хунда, имеем следующее:

| № электрона (в порядке заполнения орбиталей) | n | 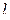 | 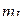 | 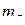 |
|
| 1 | 0 | 0 | 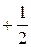 или или 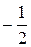 |
| 1 | 0 | 0 | 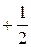 или или 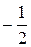 | |
|
| 2 | 0 | 0 | 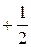 или или 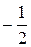 |
| 2 | 0 | 0 | 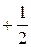 или или 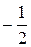 | |
|
| 2 | 1 | +1 | 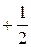 или или 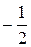 |
| 2 | 1 | 0 | 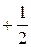 или или 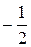 | |
| 2 | 1 | –1 | 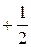 или или 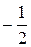 |
 2020-09-24
2020-09-24 1473
1473