Лабораторные методы исследования, проводимые при СН, должны включать клинические анализы крови и мочи, электролиты сыворотки, оценку скорости клубочковой фильтрации, глюкозу, печеночные пробы. Дополнительные методы исследования выполняются при наличии показаний. Учитывая, что в лечении больных СН используются препараты, влияющие на уровень калия в крови, определение показателя является обязательным.
Определение натрийуретических пептидов – мозгового натрийуретического пептида (МНУП) и N-конечного его фрагмента – является принципиальным для подтверждения диагноза СН. Их синтез возрастает при повышении давления в предсердиях. Напряжение стенок миокарда при повышении давления наблюдается независимо от варианта СН и сопровождается повышением уровня МНУП в крови. Поэтому в последних рекомендациях подтверждение или исключение СН базируется на уровне пептида.
Электрокардиография. Изменения не специфичны и отражают перемены, характерные для основного заболевания, нарушения ритма и проводимости и/или недостаточности коронарного кровообращения.
Суточное мониторирование ЭКГ по Холтеру обладает более широкими диагностическими возможностями по сравнению с ЭКГ покоя по выявлению транзиторной ишемии миокарда, нарушений ритма и проводимости. Так, нарушения ритма у больных с СН при холтеровском мониторировании выявляются в 2 раза чаще, чем на ЭКГ покоя. При этом характерно чрезвычайное разнообразие аритмий: предсердная и желудочковая экстрасистолия, предсердная и желудочковая тахикардия, трепетание и фибрилляция предсердий.
Рентгенологическое исследование органов грудной клетки позволяет выявить увеличение размеров сердца и наличие застойных явлений в малом круге кровообращения. Помогает в проведении дифференциальной диагностики заболеваний органов дыхательной системы и контроль эффективности проводимой терапии.
Эхокардиография является чрезвычайно важным и основным методом оценки показателей центральной гемодинамики и внутрисердечной кинетики. Благодаря проведению ультразвукового исследования можно уточнить этиологию ХСН, определить характер и выраженность дисфункции левого желудочка, объективно оценить динамику процесса и эффективность терапии.
При проведении эхокардиографии в М-режиме проводят измерение размеров полостей сердца, оценивают структуру и функциональную состоятельность клапанного аппарата, уточняют однородность миокарда, его сократительную способность. Обязательным показателем для определения варианта СН является вычисление фракции выброса. Оценка диастолической функции проводится на основании исследования трансмитрального потока при допплеровском исследовании. Оно позволяет не только выявить нарушение диастолической функции, но и определить тип нарушения: гипертрофический, рестриктивный и псевдонормальный.
С целью объективизации состояния больных с ХСН проводят тест с шестиминутной ходьбой (2). Метод был предложен в 1985 году Guyatt G.H. et al. Проба с 6-ти минутной ходьбойявляется физиологичным, простым и в тоже время информативным. Изначально этоттест использовался в пульмонологической практике. В основе метода лежит определение дистанции, которую пациент может пройти за 6 минут. Тест проводят по следующей схеме(3):
- измеряют дистанцию равную 20 м;
- устанавливают два стула на концах этой дистанции;
- пациенту предлагают ходить от стула к стулу на протяжении 6 минут в обычном для него темпе. Разрешается уменьшать темп ходьбы, даже останавливаться и отдыхать, но движения снова начинать, как только улучшится самочувствие. Время отдыха также учитывается;
- через 6 мин определяют пройденную дистанцию;
- проводят оценку симптомов, которые лимитируют проведение теста по шкале Borg:
- головокружение,
- ангинозная боль,
- одышка,
- усталость,
- пресинкопальное/синкопальное состояние.
- перед началом теста и сразу после его завершения регистрируют ЧСС, ЧДД и АД.
Результат тестирования оценивают согласно соответствующим критериям (табл.2).
Инвазивные методы исследования больных СН помогают в определении основного заболевания, более точно оценивают сократительную способность миокарда по фракции выброса. Коронарография в сочетании с вентрикулографией является наиболее точным диагностическим методом, позволяющим провести дифференциальную диагностику ишемической и некоронарогенной кардиомиопатии.
Проведение эндомиокардиальной биопсии показано и оправдано только при сложностях дифференциальной диагностики основного заболевания, когда предполагается наличие миокардита, некоторых кардиомиопатий (амилоидоз, саркоидоз, гемохроматоз), эндомиокардиального фиброэластоза, опухоли сердца, миокардиального фиброза, вызванного радиоактивным облучением.
2. Диф. Диагностика при асците.
Асцит - скопление свободной жидкости в брюшной полости; выявляется клинически (перкуторно) лишь при большом объеме свободной жидкости в брюшной полости (более 1,5 л.).
Более 80 % больных с асцитом страдают декомпенсированным хроническим или острым заболеванием печени, вторая по частоте причина асцита - карциноматоз брюшины, далее следуют ХСН, заболевания поджелудочной железы, нефротический синдром и различные заболевания брюшины.
а) асцит в связи с портальной гипертензией, вызванной чаще всего блокадой внутрипеченочного кровотока, реже тромбозом или стенозом в системе нижней полой или воротной вены.
1) Цирроз печени
2) болезнь Бадда-Киари – обструкция печеночных вен вследствие гематологических нарушений (полицитемия, дефицит протеинов С и S или антитромбина III, пароксизмальная ночная гемоглобинурия), антифосфолипидного синдрома, злокачественных заболеваний, поликистоза печени, травмы или применения оральных контрацептивов.
3) Тромбоз воротной вены
4) венооклюзионная болезнь (синдром Стюарта-Браса) – нетромботическая закупорка мелких и средних ветвей печеночных вен, развивающаяся как осложнение первичного рака печени, гипернефромы, полицитемии.
б) асцит опухолевого происхождения:
1) карциноматоз брюшины – самая частая причина развития асцита, первичная опухоль располагается преимущественно в желудке, кишечнике, поджелудочной железе, печени, яичнике, матке; для уточнения диагноза необходим парацентез с исследованием жидкости, лапароскопия, в неясных случаях – диагностическая лапаротомия.
2) первичный рак печени – часто развивается при циррозе печени, гепатите В или С, гемохроматозе, приеме гормональных контрацептивов; клинически характерна лихорадка, снижение массы тела, боли в правом верхнем квадранте живота или спине, диспепсические явления, слабовыраженная желтуха; асцит быстро развивается на поздних стадиях как за счет внутрипеченочного блока, так и за счет сдавления или тромбоза воротной вены, устойчив к лечению; асцитическая жидкость содержит много белка, в ней повышен уровень ЛДГ и карциноэмбриональный АГ, выявляются атипичные клетки.
3) синдром Мейгса – асцит при доброкачественных или злокачественных опухолей яичников, часто сочетается с правосторонним гидротораксом
4) мезотелиома брюшины – опухоль, быстро распространяющееся по брюшине, но не прорастающая в толщу органов, покрытых ею; клинически характерно быстрое нарастание асцита, умеренная боль в животе, рвота, субфебрильная температура, дисфункция желудка и кишечника; при парацентезе – геморрагическая или желеобразная жидкость с пластами злокачественных клеток.
5) саркома большого сальника – развивается из жировой клетчатки, л.у., сосудов; клинически жалобы на чувство тяжести, боль в животе, быстро нарастающая анемия, непродолжительные, но высокие подъемы температуры; иногда пальпируется опухоль в животе, свободно смещаемая из стороны в сторону
6) псевдомиксома брюшины – чаще всего наблюдается при доброкачественной кисте червеобразного отростка, при цистаденоме или цистаденосаркоме яичника, реже - при фиброме и тератоме яичника, карциномах матки, слизистой аденокарциноме кишечника; болезнь начинается с постепенного увеличения живота, позднее присоединяется похудание; при парацентезе жидкость студенистая, с трудом выделяется через троакар.
в) асцит в связи с застоем в нижней полой вене.
3. Эритремия - хронический лейкоз, для которого характерна опухолевая трансформация всех ростков кроветворения, в большей степени красного. Болезнь называют истинной полицитемией, так как заболевание сопровождается увеличением количества эритроцитов, лейкоцитов и тромбоцитов, гемоглобина и повышением свертываемости крови. Опухоль развивается из клетки-предшественницы миелопоэза.
В клинических проявлениях болезни преобладают проявления плеторы (полнокровия) и осложнения, связанные с тромбозом сосудов. Основные проявления болезни следующие:
Расширение кожных вен и изменения цвета кожи
На коже пациента, особенно в области шеи, хорошо видны проступающие, расширенные набухшие вены. При полицитемии кожа имеет красно-вишнёвый цвет, особенно выраженный на открытых частях тела — на лице, шее, кистях. Язык и губы синевато-красного цвета, глаза как бы налиты кровью (конъюнктива глаз гиперемирована). Изменён цвет мягкого нёба при сохранении обычной окраски твердого нёба (симптом Купермана). Своеобразный оттенок кожи и слизистых оболочек возникает вследствие переполнения поверхностных сосудов кровью и замедления её движения. В результате этого бо́льшая часть гемоглобина успевает перейти в восстановленную форму.
Кожный зуд
Больные испытывают кожный зуд. Зуд кожи наблюдается у 40 % пациентов. Это является специфическим диагностическим признаком для болезни Вакеза. Зуд усиливается после купания в теплой воде, что связано с высвобождением гистамина, серотонина и простагландинов.
Наличие эритромелалгии
Это кратковременные нестерпимые жгучие боли в кончиках пальцев рук и ног, сопровождающиеся покраснением кожи и появлением багровых цианозных пятен. Появление болей объясняется повышенным количеством тромбоцитов и возникновением в капиллярах микротромбов. Хороший эффект при эритромелалгии отмечается от приёма аспирина.
Увеличение селезёнки (спленомегалия)
Частый симптом эритремии — увеличение селезенки разной степени. Может быть увеличена и печень (гепатомегалия). Это обусловлено чрезмерным кровенаполнением и участием гепатолиенальной системы в миелопролиферативном процессе.
Развитие язв в двенадцатиперстной кишке и желудке
В 10–15 % случаев развивается язва двенадцатиперстной кишки, реже желудка, что связано с тромбозами мелких сосудов и трофическими нарушениями в слизистой оболочке, ведущим к снижению её устойчивости к Helicobacter pylori.
Возникновение тромбов в сосудах
Раньше тромбоз сосудов и эмболия были главными причинами смерти при полицитемии. У больных отмечается склонность к образованию тромбов вследствие повышенной вязкости крови, тромбоцитоза и изменениями сосудистой стенки. Это приводит к нарушениям кровообращения в венах нижних конечностей, мозговых, коронарных и селезёночных сосудах.
Наличие кровотечений
Наряду с повышенной свёртываемостью крови и тромбообразованием при полицитемии наблюдаются кровотечения из дёсен и расширенных вен пищевода.
Упорные суставные боли и повышение уровня мочевой кислоты
Многие больные (в 20 %) жалуются на упорные боли в суставах подагрической природы, так как отмечается увеличение уровня мочевой кислоты
Боли в ногах
Больные жалуются на упорные боли в ногах, причиной которых является облитерирующий эндартериит, сопутствующий эритремии, и эритромелалгия.
Болезненность плоских костей
При поколачивании плоских костей и давлении на них они болезненны, что часто наблюдается при гиперплазии костного мозга.
Общие жалобы
Ухудшение кровообращения в органах ведёт к жалобам больных на усталость, головную боль, головокружение, шум в ушах, приливы крови к голове, утомляемость, одышку, мелькание мушек перед глазами, нарушение зрения. Артериальное давление повышено, что является компенсаторной реакцией сосудистого русла на увеличение вязкости крови. Часто развиваются сердечная недостаточность, кардиосклероз.
Лабораторные показатели при истинной полицитемии
Количество эритроцитов увеличено и обычно составляет 6—8 × 10^12 /л и более. Гемоглобин повышается до 180—220 г/л. Цветной показатель, как правило, меньше единицы (0,7—0,6). Общий объем циркулирующей крови значительно увеличен в 1,5—2,5 раза, в основном за счёт увеличения количества эритроцитов. Показатель гематокрита (соотношение форменных элементов крови и плазмы) резко изменяется за счёт повышения эритроцитов и достигает 65 % и более. Число ретикулоцитов в крови повышено до 15—20 ‰, что свидетельствует об усиленной регенерации эритроцитов. Отмечается полихромазия эритроцитов, в мазке можно обнаружить отдельные эритробласты. Увеличено количество лейкоцитов в 1,5—2 раза (до 10—12 × 10^9 /л). У некоторых больных лейкоцитоз может достигать ещё более высоких цифр. Увеличение происходит за счет нейтрофилов, содержание которых увеличивается до 70—85 %. Наблюдается палочкоядерный, реже миелоцитарный сдвиг (сдвиг лейкоцитарной формулы влево). Увеличивается количество эозинофилов, реже и базофилов. Число тромбоцитов увеличено до 400—600 × 10^9 /л, иногда больше. Вязкость крови значительно повышена. СОЭ замедлена (1—2 мм/час). Увеличивается уровень мочевой кислоты.
Большое значение при постановке диагноза истинной полицитемии имеет:
Оценка клинических, гематологических и биохимических показателей (изменение гематокрита, количества эритроцитов, лейкоцитов, тромбоцитов, повышение вязкости крови, снижение СОЭ, увеличение содержания щелочной фосфатазы, сывороточного витамина В12);
Характерный внешний вид больного: специфическая окраска кожи и слизистых оболочек), увеличение селёзенки, печени;
Склонность больного к тромбозам.
Необходимо исключить заболевания, где есть гипоксия и неадекватное лечение витамином В12. Для уточнения диагноза возможно проведение трепанобиопсия и гистологическое исследование костного мозга.
Для подтверждения истинной полицитемии наиболее часто используются показатели:
Увеличение массы циркулирующих эритроцитов:
для мужчин > 36 мл/кг;
для женщин > 32 мл/кг;
Увеличение гематокрита: > 52 % мужчин и > 47 % у женщин;
Увеличение гемоглобина: > 185 г/л у мужчин и > 165 г/л у женщин;
Насыщение артериальной крови кислородом более 92 %;
Увеличение селезёнки (спленомегалия);
Снижение веса;
Слабость;
Потливость;
Отсутствие вторичных эритроцитозов;
Наличие генетических аномалий в клетках костного мозга (кроме наличия хромосомной транслокации Филадельфийской хромосомы или с перестроенным геном Bcr-Abl;
Образование колоний эритроидными клетками in vivo;
Лейкоцитоз > 12,0× 10^9 /л (при отсутствии температурной реакции, инфекций и интоксикаций);
Тромбоцитоз > 400× 10^9 /л;
Увеличение содержания щелочной фосфатазы нейтрофильных гранулоцитов > 100 ед. (при отсутствии инфекций);
Уровень сывороточного витамина В12 > 2200 нг;
Низкий уровень эритропоэтина;
Пункция костного мозга и гистологическое исследование пунктата, полученного с помощью трепанобиопсии, показывают увеличение мегакариоцитов.
В основе лечения лежат уменьшение вязкости крови и борьба с осложнениями — тромбообразованием и кровотечениями. Вязкость крови напрямую связана с количеством эритроцитов, поэтому кровопускание и химиотерапия (циторедуктивная терапия), уменьшающие массу эритроцитов, нашли применение при лечении истинной полицитемии. Дополнительно применяют средства симптоматического действия. Лечение больного и его наблюдение должно осуществляться гематологом.
Кровопускание (флеботомия) — ведущий метод лечения. Кровопускание уменьшает объём крови и нормализует гематокрит. Кровопускание проводят при увеличении объёма циркулирующей крови и при гематокрите > 55 %. Необходимо поддерживать уровень гематокрита ниже 45 %. Удаляют 300—500 мл крови с промежутками в 2—4 дня до ликвидации плеторического синдрома. Уровень гемоглобина доводят до 140—150 г/л. Перед кровопусканием с целью улучшения реологических свойств крови и микроциркуляции показано внутривенное введение 400 мл реополиглюкина и 5000 ЕД гепарина. Кровопускание уменьшает зуд кожи. Противопоказанием к кровопусканию является увеличение тромбоцитов более 800 × 10^9 /л. Кровопускание часто сочетается с другими методами лечения.
Кровопускание с успехом можно заменить эритроцитоферезом. Эритроцитоферез – метод экстракорпоральной гемокоррекции, основанный на выведении определенных клеточных компонентов крови больного – эритроцитов. Показания к нему соответствуют показаниям к обычному кровопусканию.
Эритроцитоферез – проводят с целью реокоррекции при плеторическом синдром, сопровождающем полицитемию, при вторичных эритроцитозах, а также с целью опосредованной детоксикации – при гемохроматозе. В этом случае удаление эритроцитов приводит к активации эритропоэза и увеличению потребления железа в костном мозге.
У лиц с высоким риском тромбозов совместно с кровопусканием или в случае не эффективности поддержания гематокрита только кровопусканием проводят циторедуктивную терапию.
Для подавления пролиферации тромбоцитов и эритроцитов применяют препараты из разных фармакологических групп: антиметаболитов, алкилирующих и биологических веществ. Каждый препарат имеет свои особенности применения и противопоказания.
Назначают «Имифос», бусульфан («Миелосан», «Милеран»), «Миелобромол», хлорамбуцил («Лейкеран»). В последние годы применяют гидроксикарбамид («Гидреа», «Литалир», «Сиреа»), пипоброман («Верците», «Амедел»). Применение гидроксимочевины показано лицам старших возрастных групп.
Из биологических веществ применяют рекомбинантный интерферон-α2b («Интрон А»), который подавляет миелопролиферацию. При применении интерферона в большей степени снижается уровень тромбоцитов. Интерферон предотвращает развитие тромбогеморрагических осложнений, уменьшает кожный зуд.
В последние годы сужается применение радиоактивного фосфора (32P). Лечение эритремии радиоактивным фосфором впервые применено Джоном Лоуренсом в 1936 году. Он угнетает миелопоэз, в том числе эритропоэз. Применение радиоактивного фосфора связано с большим риском развития лейкоза.
Для уменьшения количества тромбоцитов применяют анагрелид в дозе 0,5—3 мг в день.
Применение иматиниба при истинной полицитемии ещё не вышло за стадию клинических исследований.
Билет №26
1. Инфекционный эндокардит (ИЭ) – инфекция эндокарда, обычно бактериальная (чаще стрептококковая или стафилококковая) либо грибковая. Он может проявляться лихорадкой, шумами в сердце, петехиями, анемией, эмболиями и вегетациями на эндокарде. Вегетации могут приводить к клапанной недостаточности или обструкции, абсцессу миокарда или микотической аневризме. Для диагностики ИЗ требуется высев микроорганизмов из крови и проведение эхокардиографии. Лечение ИЭ – длительная антибактериальная терапия, иногда хирургическое лечение.
Эндокардит обычно означает инфекцию эндокарда (то есть инфекционный эндокардит). Термин эндокардит также может включать неинфекционный эндокардит, при котором стерильные тромбоциты и фибриновые тромбы фиксируются на клапанах сердца и прилегающем эндокарде. Неинфекционный эндокардит иногда может приводить к инфекционному эндокардиту. Оба могут привести к эмболизации и нарушению функции сердца.
Диагноз инфекционного эндокардита обычно устанавливается с учетом совокупности всех клинических данных, а не результата одного исследования.
Инфекционный эндокардит может возникнуть в любом возрасте. Мужчины заболевают в два раза чаще, чем женщины. Лица, употребляющие внутривенные наркотики, пациенты с ослабленным иммунитетом и пациенты с искусственными клапанами сердца и другими внутрисердечными устройствами имеют наибольший риск.
Этиология
Здоровое сердце относительно устойчиво к инфекции. Бактерии и грибы не легко адгезируются к поверхности эндокарда, и постоянный ток крови помогает предотвратить их оседание на эндокард. Таким образом, для развития эндокардита требуются, как правило, 2 условия:
Предшествующая аномалия эндокарда
Присутствие микроорганизмов в кровотоке (бактериемия)
Реже, массивная бактериемия или особо вирулентные микроорганизмы поражают нормальные клапаны.
Эндокардиальные факторы
Эндокардит часто поражает клапаны сердца. Основными предрасполагающими факторами ИЭ являются врожденные пороки сердца, ревматическое поражение клапанов, бикуспидальный или кальцинированный аортальный клапан, пролапс митрального клапана, гипертрофическая кардиомиопатия и предшествующий эндокардит. Протезирование клапанов и других внутрисердечных устройств представляет особый риск. Иногда пристеночные тромбы, дефекты межжелудочковой перегородки и область открытого аортального протока подвергаются инфицированию. Ядром инфекции является стерильная фибринозно-тромбоцитарная вегетация, формирующаяся при высвобождении поврежденными эндотелиальными клетками тканевых факторов.
Инфекционный эндокардит чаще всего поражает левые отделы сердца (например, митральный или аортальный клапаны). Примерно в 10–20% случаев поражаются правые отделы (трикуспидальный или пульмональный клапаны). Внутривенные наркоманы имеют более высокий риск развития правостороннего эндокардита (около 30–70%).
Микроорганизмы
Микроорганизмы, поражающие эндокард, могут попадать из отдаленных очагов инфекции (например, кожный абсцесс, воспаленные или инфицированные десны, инфекция мочевыводящих путей) или через очевидные входные ворота, такие как центральный венозный катетер или места инъекций препаратов. Практически любой чужеродный имплантированный материал (например, желудочковый или перитонеальный шунт, протез) подвергается риску бактериальной колонизации, тем самым становясь источником бактериемии и, следовательно, эндокардита. Эндокардит может быть результатом асимптомной бактериемии, которая, как правило, возникает во время инвазивных стоматологических, медицинских или хирургических вмешательств. Даже чистка зубов и жевание могут приводить к бактериемии (обычно зеленящим стрептококком) у пациентов с гингивитом.
Возбудители различаются в зависимости от места инфекции, источника бактериемии и факторов риска пациента (например, внутривенные наркоманы), но в 80–90% случаев стрептококки и Staphylococcus aureus являются причиной ИЭ. Энтерококки, грам-отрицательные бациллы, микроорганизмы группы HACEK (Haemophilus, гемофильные бактерии, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens и Kingella kingae) и грибки являются причиной большинства других случаев.
Болезнь протекает в трех стадиях:
Бактериемия: микроорганизмы присутствуют в крови
Адгезия: микроорганизм присоединяется к аномальному или поврежденному эндотелию с помощью поверхностных адгезинов
Колонизация: пролиферация организма вместе с развитием воспаления, что приводит к образованию зрелых вегетаций
Многие из возбудителей образовывают полисахаридные биопленки, которые защищают их от иммунной защиты хозяина и препятствуют проникновению антибиотиков
Патофизиология
Эндокардит имеет локальные и системные осложнения.
Локальные осложнения
Местные последствия инфекционного эндокардита включают:
Абсцессы миокарда с деструкцией тканей, а иногда и с нарушением проводимости (чаще при нижне-перегородочных абсцессах).
Внезапная, тяжелая клапанная регургитация может привести к сердечной недостаточности и смерти (чаще из-за поражения митрального или аортального клапана).
Аортит в связи с распространением инфекции из прилегающих структур.
Для больных с протезированными клапанами характерно развитие абсцессов клапанного кольца, обструктивных вегетаций, абсцессов миокарда и грибковых аневризм, что проявляется клапанной обструкцией, дисфункцией клапана и нарушением проводимости.
Системные осложнения
Системные осложнения в первую очередь обусловлены
Эмболизация инфицированным материалом из сердечного клапана
Иммуно-опосредованные явления (в основном при хронической инфекции)
Поражение правых камер сердца характеризуется развитием септических эмболий легочной артерии, которые могут привести к инфаркту легкого, пневмонии или эмпиеме. Поражение левых камер сердца может приводить к эмболиям любых органов, особенно часто почек, селезенки и центральной нервной системы. Микотические аневризмы могут формироваться в любых крупных сосудах. Часто развиваются эмболии кожи и сетчатки. Вследствие отложения иммунных комплексов развивается диффузный гломерулонефрит.
Классификация
Инфекционный эндокардит может иметь вялотекущее, подострое течение или более острое, молниеносное течение с высокой опасностью развития быстрой декомпенсации.
Подострый бактериальный эндокардит (ПБЭ), несмотря на агрессивность, обычно развивается незаметно и прогрессирует медленно (т.е от нескольких недель до месяцев). Источник инфекции или входные ворота часто не выявляются. Возбудителями ПСЭ чаще всего являются стрептококки (особенно зеленящий, микроаэрофильный, анаэробный, стрептококки группы D и энтерококки), реже причиной могут быть золотистый и эпидермальный стафилококки - S. aureus, Staphylococcus epidermidis, стрептококки Gemella morbillorum, Abiotrophia defectiva (ранее, Streptococcus defectivus), Granulicatella и требовательный к питательным средам Haemophilus. Стрептококковый подострый эндокардит часто развивается на пораженных клапанах после асимптомной бактериемии, вследствие инфекций периодонта, гастроинтестинальных и урогенитальных инфекций.
Острый бактериальный эндокардит (ОБЭ) обычно развивается внезапно и прогрессирует быстро (т.е. в течение дней). Источник инфекции или входные ворота часто легко выявляются. Когда инфекция высоко вирулентна или бактериальное воздействие массивно, острый бактериальных эндокардит может поражать нормальные клапаны сердца. Он обычно вызван золотистым стрептококком S. aureus, гемолитическим стрептококком группы А, пневмококком или гонококком.
Эндокардит протезированного клапана (ЭПК) развивается у 2–3% пациентов в течение первого года после протезирования клапана и в 0,5% в последующие годы. Чаще развивается после замены аортального клапана, нежели митрального и в одинаковой степени поражает как механические, так и биологические протезы. Раннее начало инфекции (<2 мес. после хирургического лечения) вызвано главным образом инфицированием в ходе операции бактериями, резистентными к противомикробным препаратам (S. epidermidis, дифтероиды, колиформные бациллы, Candida, Aspergillus). Позднее начало инфекции происходит в основном в результате контаминации низко-вирулентными организмами во время оперативного вмешательства или при транзиторных бессимптомных бактериемиях, чаще всего благодаря попаданию стрептококка; S. epidermidis; дифтероидов; и требовательной к средам грамотрицательной палочки Haemophilus, Actinobacillus actinomycetemcomitans, и Cardiobacterium hominis.
Клинические проявления
Клиническая картина зависит от классификации, но она неспецифична.
Подострый септический эндокардит
Первоначально симптомы подострого бактериального эндокардита смазанные: субфебрильная лихорадка (<39 °С), ночные поты, утомляемость, недомогание и потеря веса. Возможны озноб и артралгии. Симптомы клапанной недостаточности могут быть первым признаком, ведущим к постановке диагноза. Первоначально менее чем (≤) у 15% пациентов наблюдается лихорадка или шумы в сердце, но со временем оба эти симптома развиваются практически у всех больных. Объективное исследование может выявлять бледность, лихорадку, изменение ранее существовавшего шума или появление шума новой регугитации и тахикардию.
Эмболия сетчатки может вызвать округлые или овальные геморрагические повреждения сетчатки с маленьким белым центром (пятна Рота). Кожные проявления включают петехии (на верхней половине туловища, конъюнктиве, слизистых оболочках и дистальных отделах конечностей), болезненные красные подкожные узелки на кончиках пальцев (узелки Ослера), безболезненные геморрагические пятна на ладонях и подошвах (пятна Джейнуэя) и подногтевые кровоизлияния. Около 35% пациентов имеют поражение ЦНС, включая транзиторные ишемические атаки, инсульты, токсическую энцефалопатию и при разрыве микотической аневризмы ЦНС – абсцесс мозга и субарахноидальное кровоизлияние. Почечная эмболия может быть причиной болей в поясничной области и, реже макрогематурии. Селезеночная эмболия может вызывать боли в верхнем левом квадранте живота. Длительная инфекция может приводить к спленомегалии или утолщению концевых фаланг пальцев рук и ног в виде «барабанных палочек» и ногтевых пластинок в виде «часовых стекол».
Острый бактериальный эндокардит и эндокардит искусственного клапана
Клиническая картина острого бактериального эндокардита и эндокардита искусственного клапана подобна картине подострого бактериального эндокардита, но течение более быстрое. Лихорадка почти всегда выявляется в начале заболевания, у пациентов имеются симптомы интоксикации; иногда развивается септический шок. Сердечные шумы выявляются первоначально примерно у 50–80% пациентов и со временем у >90%. Редко развивается гнойный менингит.
Правосторонний эндокардит
Септическая эмболия легочной артерии может вызывать кашель, плевральные боли в грудной клетке и иногда кровохарканье. Характерно наличие шума трикуспидальной регургитации.
Диагностика
Посев крови
Эхокардиография, иногда – другие методы получения изображения
Клинические критерии
Так как клиническая картина неспецифична, вариабельна и может развиться незаметно, диагностика требует высокой настороженности. Эндокардит следует подозревать у пациентов с лихорадкой без явных причин инфекции, особенно если есть шум в сердце. Настороженность в плане ИЭ должна быть очень велика в том случае, если имеются положительные результаты посева крови у пациентов с патологией клапанов сердца, у пациентов, которым недавно выполнялись инвазивные процедуры или у внутривенных наркоманов. Пациенты с доказанной бактериемией должны быть тщательно и многократно обследованы на предмет новых клапанных шумов и признаков эмболии.
Кроме позитивных посевов крови, других специфических лабораторных изменений нет. Установленные инфекционные поражения эндокарда часто приводят к нормохромной нормоцитарной анемии, лейкоцитозу, повышению СОЭ, увеличению уровня иммуноглобулинов, появлению циркулирующих иммунных комплексов и положительному ревматоидному фактору, но эти изменения не помогают в постановке диагноза. В общем анализе мочи часто выявляется микрогематурия, иногда эритроцитарные цилиндры, пиурия или бактериурия.
Идентификация организмов
Идентификация возбудителя и определение его чувствительности к антибиотикам жизненно необходимы для определения тактики лечения.
Если заподозрен эндокардит, должно быть выполнено 3 забора крови на посев (20 мл каждый) в течение 24 ч (если клиническая картина представлена острым бактериальным эндокардитом, то 2 забора крови с интервалом между 1-м и 2-м в 1 час). Каждый новый забор крови должен быть произведен путем отдельной венепункции (т.е. не из ранее установленных внутрисосудистых катетеров). Забор крови не должен производиться во время наличия у пациента лихорадки или озноба, поскольку у большинства пациентов бактериемия носит постоянный характер. При эндокардите и в отсутствие предшествовавшей антибиотикотерапии все 3 посева образцов крови положительны, поскольку бактериемия продолжается; по крайней мере, 1 посев крови положительный в 99% случаев. Необходимо избегать преждевременного использования эмпирической антибактериальной терапии у пациентов с приобретенными или врожденными пороками во избежание эндокардитов с негативными посевами крови. Если ранее проводили антибактериальную терапию, следует также получить результаты гемокультуры, однако они могут быть отрицательными.
Посевы крови требуют 3–4-недельной инкубации для определенных микроорганизмов; однако некоторые запатентованные автоматически мониторирующие культуральные системы могут идентифицировать позитивные культуры в течение недели. Другие микроорганизмы (например, Aspergillus sp) могут не выявляться при посевах крови. Некоторые микроорганизмы (например, Coxiella burnetii, Bartonella sp, Chlamydia psittaci, Brucella sp) требуют серологической диагностики; другие микроорганизмы (например, Legionella pneumophila) требуют специальную культуральную среду или ПЦР (например, Tropheryma whippelii). Негативные результаты посевов крови могут быть следствием первичной антибактериальной терапии, инфицированности микроорганизмами, которые не растут на стандартных питательных средах, или указывать на другой диагноз (например, неинфекционный эндокардит, миксома предсердия с эмболиями, васкулит).
Методы визуализации
На начальном этапе необходимо выполнение эхокардиаграфии, обычно трансторакальной (ТТЭ), а не трансэзофагеальной (ТЭЭ). ТЭЭ является более чувствительной (т.е. способна выявлять вегетации маленького размера, невидимые при ТТЭ),
Чреспищеводную эхокардиографию следует проводить при таких случаях:
Пациенты имеют искусственный клапан
Трансторакальная эхокардиография не является диагностической
Диагноз инфекционного эндокардита был установлен клинически (проводится для выявления перфораций, абсцессов и свищей)
Иногда используется КТ, если при ЧПЭ не возможно точно определить околоклапанные абсцессы, а также для обнаружения микотических аневризм. ПЭТ является новым инструментом для диагностики эндокардита, который возникает в простетических и внутрисердечных устройствах. В настоящее время патологии, выявленные при КТ и ПЭТ включены в Европейские рекомендации в качестве основных критериев.
Диагностические критерии
Инфекционный эндокардит достоверно диагностируется, когда микроорганизмы выявляются гистологически (или культурально) в эндокардиальных вегетациях, полученных в ходе операции на сердце, эмболэктомии или аутопсии. Так как вегетации обычно недоступны для исследования, существуют разнообразные клинические критерии для установления диагноза. К ним относятся пересмотренные критерии Дюка (с чувствительностью и специфичностью > 90%— Диагностические требования к диагнозу инфекционного эндокардита в соответствии с пересмотренными критериями Дюка а также Пересмотренные клинические критерии Дюка для диагностики инфекционного эндокардита) и модифицированные критерии Европейского общества кардиологии (ESC) 2015 года (1).
Критерии ESC аналогичны модифицированным критериям Дюка, но в качестве основных критериев включают результаты расширенной визуализации как указано далее:
Вегетации, абсцесс, псевдоаневризма, внутрисердечная фистула, клапанная перфорация или аневризма или новое частичное раскрывание створок искуссвенного клапана, которые выявлены при эхокардиографии
Аномальная активность вокруг искусственного клапана (имплантированного > 3 мес раньше), обнаруженная при ПЭТ/КТ или ОФЭКТ/КТ с лейкоцитами, меченными радиоактивными изотопами
Околоклапанные поражения, выявленные при КТ сердца
Критерии ESC также отличаются от малых модифицированных критериев Дюка, детализируя, что только лишь выявление бессимптомных сосудистых явлений при визуализации является достаточным.
Диагностические требования к диагнозу инфекционного эндокардита в соответствии с пересмотренными критериями Дюка
| Состояние клинической диагностики | Критерии |
| Явный эндокардит | Одно из следующего: 2 основных критерия 1 основной и 3 малых 5 малых |
| Возможный эндокардит | Одно из следующего: 1 основной и 1 малый 3 малых |
| Эндокардит исключен | Одно из следующего: Достоверный альтернативный диагноз, объясняющий данные, соответсвующие инфекционному эндокардиту Разрешение симптомов и признаков после ≤ 4 дней антимикробной терапии Отсутствие патологических признаков инфекционного эндокардита при операции или аутопсии Несоответствие клиническим критериям возможного эндокардита |
Пересмотренные клинические критерии Дюка для диагностики инфекционного эндокардита
| Основные критерии Два позитивных посева крови на типичные для инфекционного эндокардита микроорганизмы взятые с разницей >12 часов Все из 3 или большая часть из 4 или более положительных результатов бакпосева крови (с разницей между первым и последним бакпосевом по меньшей мере 1 ч) на организмы, кототрые характерны для эндокардита Серологическое подтверждение Coxiella burnetii (титр иммуноглобулина G> 1:800) или одна положительная гемокультура при Coxiella burnetii Эхокардиографические признаки поражения эндокарда: Подвижные интракардиальные массы на клапанах, на поддерживающих структурах, на пути струи регургитации или на имплантированном материале без других анатомических объяснений Миокардиальный абсцесс Новая дисфункция протезированного клапана Новая клапанная регургитация |
| Дополнительные критерии Предраспологающие к инфекционному эндокардиту заболевания сердца Внутривенное введение антибиотиков Лихорадка ≥ 38,0° С †Сосудистые проявления: Артериальные эмболии Септическая эмболия легочной артерии Микотическая аневризма Кровоизлияния в мозг Геморрагии конъюнктивы Повреждение Джейнуэя Иммунные проявления: Гломерулонефрит Узелки Ослера Пятна Рота Ревматоидный фактор Микробиологические подтверждения инфекции, не соответствующие большим критериям Серологические подтверждения инфекции, обусловленной потенциальным возбудителем инфекционного эндокардита |
Прогноз
Без лечения инфекционный эндокардит всегда имеет летальный исход. Даже при лечении летальный исход более вероятен и прогноз хуже у пожилых людей и у людей, имеющих
Инфекция резистентными организмами
Основное заболевание
Длительная задержка лечения
Поражение аортального клапана или нескольких клапанов
Крупные вегетации
Полимикробная бактериемия
Инфекция искусственного клапана
Микотические аневризмы
Абсцесс клапанного кольца
Основные эмболические осложнения
Септический шок чаще всего возникает у пациентов, страдающих сахарным диабетом, острой почечной недостаточностью, инфекцией, вызванной S. aureus, наличием вегетаций > 15 мм, а также у пациентов, имеющих признаки персистирующей инфекции. Смертность при эндокардите, вызванном зеленящим стептококком без серьезных осложнений составляет < 10%, но достигает практически 100% при эндокардите, вызванном Aspergillus после хирургического вмешательства на искусственном клапане.
При правостороннем эндокардите прогноз лучше чем при левостороннем, т.к. дисфункция трикуспидального клапана переносится лучше, отсутствуют системные эмболии, а также правосторонний эндокардит, вызванный S. aureus, лучше реагирует на антимикробную терапию.
Лечение
Антибиотики внутривенно (с учетом возбудителя и его чувствительности к антибиотикам)
Иногда выполняется хирургическая санация, пластика или замена клапана
Оценка состояния и лечение зубов (для минимизации оральных источников бактериемии)
Удаление потенциального источника бактериемии (например, внутренних катетеров, устройств)
Лечение представляет собой длительный курс антибактериальной терапии (1). Хирургическое лечение может потребоваться при развитии деструкции клапанов или резистентности к терапии. Как правило, антибиотики вводятся внутривенно. Так как курс терапии обычно длится от 2 до 8 нед, то часто внутривенная антибактериальная терапия проводится амбулаторно.
Любые очевидные источники бактериемии должны быть санированы: некротические массы удалены, абсцессы дренированы, чужеродные материалы и инфицированные устройства удалены. Людям с инфекционным эндокардитом необходимо проверяться у стоматолога и лечить заболевания полости рта, которые могут вызывать бактериемию и последующий эндокардит. Имеющиеся внутривенные катетеры (особенно центральный венозный катетер) должны быть заменены. Если эндокардит персистирует у пациента с недавно установленным центральным венозным катетером, он также должен быть удален. Микроорганизмы в составе биопленок, адгезированных на катетерах и других устройствах, могут быть резистентны к антибактериальной терапии, вследствие этого возникает рецидив болезни. Если вместо болюсного введения препаратов используется непрерывная инфузия, она не должна прерываться на длительный срок.
Режимы антибактериальной терапии
Препараты и дозы зависят от микроорганизма и его чувствительности к антибиотикам. (для стандартных схем, Некоторые антибактериальные режимы при эндокардите в США).
Хотя состояние большинства пациентов достаточно стабильно, чтобы дождаться результатов бакпосева, у тяжелобольных пациентов может потребоваться эмпирическая антибактериальная терапия до идентификации организма. Антибиотики не следует назначать до тех пор, пока не будет получен адекватный материал для бакпосева крови (2 или 3 образца из разных мест с интервалом более 1 часа). Антибиотики должны быть широкого спектра действия для охвата всех вероятных организмов, которые, как правило, включают чувствительные и резистентные стафилококки, стрептококки и энтерококки. Эмпирические схемы антибиотикотерапии должны отражать местные закономерности инфекции и антибиотикорезистентности; однако типичные примеры охвата антибиотиками широкого спектра действия могут включать
Собственные клапаны: Ванкомицин от 15 до 20 мг/кг в/в каждые 8-12 ч (доза не более 2 г)
Искусственный клапан: Ванкомицин от 15 до 20 мг/кг в/в каждые 8-12 ч (доза не более 2 г) плюс гентамицин 1 мг/кг каждые 8 ч плюс цефепим 2 г в/в каждые 8 ч или имипенем 1 г в/в каждые 6-8 ч (максимальная доза 4 г/сут)
Эмпирическую схему терапии необходимо скоррегировать на основании результатов посева культуры как можно скорее.
Внутривенные наркоманы часто не придерживаются терапии, злоупотребляют внутривенным доступом и, как правило, слишком рано покидают клинику. Для таких пациентов возможен короткий курс внутривенной терапии или (что менее предпочтительно) пероральной терапии. Для правостороннего эндокардита, вызванного метициллин-чувствительным S. aureus, применение нафциллина 2 г внутривенно каждые 4 ч с гентамицином 1 мг/кг внутривенно каждые 8 ч в течение 2 нед. эффективно в такой же степени, как и 4-х-недельный режим ципрофлоксацина 750 мг 2 раза в день перорально с рифампицином 300 мг перорально внутрь 2 раза в день. Левосторонние эндокардиты не поддаются лечению 2-х-недельными курсами терапии.
Хирургическое лечение при эндокардите
Для лечения инфекционного эндокардита иногда необходимо хирургическое вмешательство (некрэктомия, пластика клапана или замена клапана)(2). Хирургическое вмешательство, как правило, показано при
Пациентам с сердечной недостаточностью (особенно тем, у которых имеется эндокардит искусственного, собственного аортального или митрального клапанов, а также пациентам с отеком легких или кардиогенным шоком)
Пациентам с неконтролируемой инфекцией (с персистирующей инфекцией, инфекцией грибковыми или резистентными организмами, рецидивирующим эндокардитом искусственных клапанов или эндокардитом, осложненным блокадой сердца, абсцессом, аневризмой, фистулой или увеличивающимися вегетациями)
Пациентам с риском развития эмболии (особенно тем, которые имеют эндокардит искусственного, собственного аортального или митрального клапанов и крупные вегетации [в США определяют как > 10 мм] или тем, у кого наблюдается рецидивирующая эмболия)
Сроки проведения оперативного вмешательства зависят от клинической ситуации. Если сердечная недостаточность, вызванная ИЭ, поддающимся лечению, усугубляется (особенно если возбудителем являются S. aureus, грамотрицательные палочки или грибы), оперативное вмешательство показано только после проведения антибактериальной терапии в течение 24–72 ч. Пациентам с протезированными клапанами сердца оперативное вмешательство показано, если при чреспищеводной эхокардиографии выявляется дисфункция протеза на фоне параклапанного абсцесса, когда дисфункция протеза ухудшает течение сердечной недостаточности, когда рецидивируют эмболии или когда инфекция вызвана резистентными к антибиотикам микроорганизмами.
Правосторонний эндокардит обычно лечат консервативно. Если необходимо хирургическое вмешательство (в связи с сердечной недостаточностью или отсутствием терапевтического ответа), то пластика клапана считается предпочтительнее замены для того, чтобы избежать будущей инфекции искусственного клапана, что связано с продолжением в/в потребления наркотиков.
Хирургическое вмешательство обычно откладывают на месяц после внутричерепного кровоизлияния или обширного ишемического инсульта.
Ответ на лечение
После начала терапии, пациенты с пенициллин – чувствительным стрептококковым эндокардитом обычно отмечают улучшение самочувствия, лихорадка уменьшается в течение 3–7 дней. Лихорадка может быть обусловлена иными причинам, нежели персистенция инфекции (в частности, аллергия на препараты, флебиты, эмболии с развитием инфаркта). Пациенты со стафилококковым эндокардитом обычно отвечают на терапию медленнее. Уменьшение размеров вегетаций можно наблюдать при повторных эхокардиографиях. После окончания терапии следует провести эхокардиографию для того, чтоб установить новый исходный уровень внешнего вида клапанов (включая стерильные вегетации) и недостаточности.
Рецидив обычно возникает в течение 4 нед. Антибактериальная терапия может быть эффективна, но оперативное лечение также может быть показано. У пациентов без протезированных клапанов возобновление клиники эндокардита после 6 нед. обычно связано с новой инфекцией, нежели с рецидивом. Даже после успешной антибактериальной терапии, стерильная эмболия и разрывы клапанов могут возникнуть в течение 1 года. Риск рецидива является значительным, поэтому рекомендуется проводить гигиену зубов и кожи постоянно на протяжении всей жизни. Пациентам, которым по какой-либо причине необходима антибактериальная терапия, необходимо провести как минимум 3 забора крови для бактериологического исследования перед началом приема антибиотиков.
2. Дифференциальная диагностика желтух.
Желтуха - это клинический синдром, характеризующийся желтушным окрашиванием кожи и видимых слизистых оболочек, обусловленный накоплением в тканях и крови билирубина.
От истинной желтухи нужно отличать желтуху ложную (каротиновую желтуху). Последняя представляет собой желтушное окрашивание кожи (но не слизистых оболочек!) вследствие накопления в ней каротинов при длительном и обильном употреблении в пищу моркови, свеклы, апельсинов, тыквы, а также возникающая при приёме внутрь акрихина, пикриновой кислоты и некоторых других препаратов. Важно! Содержание билирубина в сыворотке крови в пределах нормы.
Когда установлено, что у больного действительно имеет место желтуха, наступает более сложный этап дифференциальной диагностики, так как причин желтухи довольно много и генез ее неоднозначен. Она может быть обусловлена повышенным гемолизом эритроцитов, поражением печени, холестазом или сочетанием этих факторов.
При дифференциальной диагностике желтух необходимо учитывать особенности нарушений отдельных звеньев пигментного обмена. Поэтому вначале коротко вспомним основные данные физиологии билирубина.
Эритроциты живут приблизительно 120 дней, а затем разрушаются, главным образом, в печени, селезёнке и костном мозге, при этом разрушается и гемоглобин. Распад гемоглобина протекает в клетках макрофагов, в частности, в звёздчатых ретикулоэндотелиоцитах, а также в гистиоцитах соединительной ткани любого органа по следующей схеме
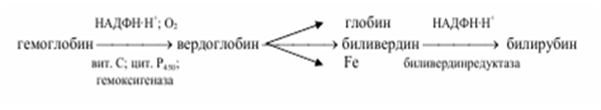
Метаболизм желчных пигментов представлен на следующей схеме.
Образующийся при распаде гемоглобина билирубин поступает в кровь и связывается альбуминами плазмы — это непрямой билирубин. В отличие от прямого билирубина, непрямой не даёт цветную реакцию с диазореактивом Эрлиха, пока белки плазмы крови не осаждены спиртом. Непрямой билирубин называется также свободным, поскольку его связь с альбуминами плазмы не химическая (не ковалентная), а адсорбционная.
Попадая в печень, билирубин ковалентно связывается с 2 молекулами УДФ-глюкуроновой кислоты, образуя диглюкуронид билирубина, который называется связанным билирубином. Связанный билирубин называется также прямым, поскольку он легко даёт цветную реакцию с диазореактивом Эрлиха. Прямой и небольшая часть непрямого билирубина вместе с желчью поступают в тонкий кишечник, где от прямого билирубина отщепляется УДФ-глюкуроновая кислота и при этом образуется мезобилирубин. Последний в конечных отделах тонкого кишечника под воздействием микроорганизмов восстанавливается в уробилиноген, часть которого всасывается по мезентериальным сосудам и поступает в печень (истинный уробилин), где разрушается до пиррольных соединений. Большая часть уробилиногена поступает в толстый кишечник. Уробилиноген в толстом кишечнике восстанавливается в стеркобилиноген. 80 % стеркобилиногена выделяется с калом и под влиянием кислорода воздуха окисляется в стеркобилин, придающий характерную окраску стулу. Меньшая часть стеркобилиногена всасывается по нижней и средней геморроидальным венам и попадает в большой круг кровообращения, поступает в почки, которыми и выделяется. Под влиянием кислорода воздуха стеркобилиноген мочи также окисляется до стеркобилина. Нередко стеркобилин мочи называют уробилином, однако это не истинный уробилин. В норме в моче истинный уробилин отсутствует. Норма общего билирубина в крови — 1,7-20,5 мкмоль/л, из них 75 % приходится на долю свободного билирубина— 1,7 — 17,1 мкмоль/л; а 25% — на долю прямого 0,86 — 4,3 мкмоль/л.
В условиях патологии количество и соотношение между «прямым» и «непрямым» билирубином резко меняется, поэтому определение обеих форм билирубина в крови имеет огромное значение в клинике при дифференциальной диагностике различных форм желтух.
отличия конъюгированного и неконъюгированного билирубина по ряду свойств.
| Свойства | Неконъюгированный билирубин | Конъюгированный билирубин |
| В воде | Не растворим | Растворим |
| В липидах | Хорошо растворим | Не растворим |
| Белок | Не содержит (свободный) | Содержит (связанный) |
| Реакция с диазо-реактивом | Непрямая | Прямая |
| Содержание в плазме | 17 – 24 мкмоль/л | 0,7 – 1,7 мкмоль/л |
| В моче | Не появляется | Появляется |
| С глюкуроновой кислотой | Не соединяется | Соединяется |
| Токсичность | Токсичен, нейротоксичность | Не токсичен |
Классификация желтух
По этиопатогенезу различают три основных вида желтух:
1. Надпеченочные (гемолитические) – за счет чрезмерного разрушения эритроцитов и повышенной выработки билирубина
2. Печеночные (паренхиматозные, гепатоцеллюлярные) - нарушение улавливания клетками печени билирубина и связывания его с глюкуроновой кислотой
А. премикросомальные;
Б. микросомальные;
В. постмикросомальные.
3. Подпеченочные (механические, обтурационные) – за счет наличия препятствия к выделению билирубина с желчью в кишечник и обратного всасывания связанного билирубина в кровь
При проведении дифференциальной диагностики желтух важно определить принадлежность желтухи к той или иной группе, а затем проводить диагностику внутри группы.
Дифференциальная диагностика желтух должна основываться на данных анамнеза заболевания, особенностях клиники, данных лабораторных и инструментальных методов исследования.
И необходимо отметить, что и по сей день, одним из важнейших методов диагностики является определение «биохимических индикаторов, или так называемых маркеров желтух.
Все индикаторы желтух можно подразделить на три группы:
Индикаторы холестатического синдрома: щелочная фосфатаза, 5-нуклеотидаза, γ-глютамилтрансфераза, желчные кислоты, холестерин, β-липопротеиды, прямой билирубин и др.
Индикаторы цитолитического синдрома (повреждение гепатоцитов) – АЛТ, АСТ, соотношение АСТ/АЛТ < 1,33.
Индикаторы мезенхимально-воспалительного синдрома – тимоловая проба.
Нормальные показатели этих индикаторов
| ПОКАЗАТЕЛИ | НОРМА |
| Билирубин общий | 5 – 17 мкмоль/л |
| Билирубин связанный (прямой) | < 10 – 15 % от общего |
| Щелочная фосфатаза | 35 – 130 МЕ/л |
| АсАТ | 5 – 40 МЕ/л |
| АлАТ | 5 – 35 МЕ/л |
| ГГТ (γ-глютамилтрансфераза) | 10 – 48 МЕ/л |
| Холестерин | 1,8 – 4,9 ммоль/л |
| Альбумин | 35 – 50 г/л |
| γ-глобулин | 5 -15 г/л |
| Протромбиновая время | 12 -16 сек |
| ПТИ | > 80% |
Представление о билирубине мы дали выше. Сейчас же нам хотелось коротко остановится на некоторых других маркерах.
Щелочная фосфатаза – это фермент, участвующий в реакциях обмена фосфорной кислоты. Присутствует во всех органах человека, высокая активность определяется в печени, остеобластах, плаценте и кишечном эпителии. Каждая из этих тканей содержит специфичные изоферменты щелочной фосфатазы. Активность фермента повышается при механической желтухе и холестазе, незначительно повышается при первичном циррозе и новообразованиях печени, когда они протекают без желтухи.
5-Нуклеотидаза является фосфатазой, катализирующей гидролиз только нуклеотид-5-фосфатов. 5-Нуклеотидаза распространена во многих тканях человека (печень, мозг, мышцы, почки, легкие, щитовидная железа, аорта). Наибольшая активность 5-нуклеотидазы наблюдается при холестазах любой локализации. Активность фермента при холестазе возрастает параллельно со щелочной фосфатазой, но 5-нуклеотидаза более чувствительна по отношению к первичному и вторичному билиарному циррозу, а также к хроническому активному гепатиту. Главным отличием от щелочной фосфатазы является отсутствие реакции со стороны 5-нуклеотидазы на костные заболевания. Считается, что 5-нуклеотидаза представляет собой специфическую «желчную» фосфатазу.
γ-глютамилтрансфераза - то очень распространенный в тканях человеческого организма микросомальный фермент. Рост активность гамма-глютамилтрансферазы плазмы является чувствительным показателем патологии печени. Наивысшая активность наблюдается при непроходимости желчных протоков, но заметное повышение активности бывает также при остром паренхиматозном поражении, вызванном любой причиной.
Цитоплазменне ферменты АЛТ и АСТ находятся в цитоплазме и митохондриях и являются двумя самыми важными аминотрансферазами. Нормальная плазма характеризуется низкой активностью обеих ферментов. Никакой фермент не является специфическим для печени, но аланин- аминотрансфераза встречается в печени в намного высших концентрациях, чем в других органах, поэтому повышенная активность аланин-аминотрансферазы сыворотки специфичнее отображает патологию печени. Аланін- аминотрансфераза и аспартат- аминотрансфераза выделяются в кровь каждый раз, когда разрушаются печеночные клетки, поэтому повышенная активность ферментов плазмы является очень чувствительным показателем повреждения печени. Активность аланин- аминотрансферазы и аспартат- аминотрансферазы дает возможность проверять целостность клеток печени.
Определение уровней холестерина, общего белка и его фракций, позволяет судить о синтетической функции печени. А значительное повышение уровня у-глобулина характерно для хронического гепатита и цирроза печени.
А теперь перейдем к разбору отдельных видов желтух и выделеню их основных диагностических критериев.
Надпеченочные (гемолитические) желтухи.
Желтухи этой группы развиваются в результате повышенной продукции билирубина и недостаточности функции захвата его печенью. Основным в генезе этой желтухи является усиленный распад эритроцитов (гемолиз), поэтому обычно их и называют гемолитическими. Патология при этих желтухах лежит в основном вне печени.
Гемолиз бывает внутрисосудистым, когда эритроциты лизируются в крови, и внесосудистым - эритроциты подвергаются деструкции и перевариваются системой макрофагов.
Внутрисосудистый гемолиз может возникнуть вследствие механического разрушения эритроцитов при травмировании в малых кровеносных сосудах (маршевая гемоглобинурия), турбулентном кровяном потоке (дисфункция протезированных клапанов сердца), при прохождении через депозиты фибрина в артериолах (тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром, ДВС-синдром), в результате несовместимости эритроцитов по системе АВ0, резус или какой-либо другой системе (острая посттрансфузионная реакция), под влиянием комплемента (пароксизмальная ночная гемоглобинурия, пароксизмальная холодовая гемоглобинурия), вследствие прямого токсического воздействия (яд змеи кобры, инфекции), при тепловом ударе.
Внесосудистый гемолиз осуществляется преимущественно в селезенке и печени. Селезенка способна захватывать и разрушать малоизмененные эритроциты, печень различает лишь эритроциты с большими нарушениями, однако поскольку ток крови к печени примерно в 7 раз больше, чем к селезенке, печень может играть существенную роль в гемолизе.
Удаление эритроцитов из крови макрофагами происходит в основном двумя путями. Первый механизм связан с распознаванием макрофагами эритроцитов, покрытых IgG-АТ и С3, к которым на поверхности макрофагов имеются специфические рецепторы - иммуногемолитические анемии.
Второй механизм обусловлен изменениями физических свойств эритроцитов, снижением их пластичности - способности изменять свою форму при прохождении через узкую фильтрационную сеть селезенки. Нарушение пластичности отмечается при мембранных дефектах эритроцитов (наследственный микросфероцитоз), аномалиях гемоглобина, ведущих к повышению вязкости внутриклеточной среды эритроцита (серповидно-клеточная анемия), наличии включений в цитоплазме эритроцитов (бета-талассемия, альфа-талассемия) и др.
В результате усиленного распада эритроцитов образуется большое количество свободного билирубина, который печень не в состоянии захватить и не в состоянии связать весь этот билирубин с глюкуроновой кислотой. В результате в крови и тканях накапливается непрямой билирубин. Так как через печень идет повышенный поток непрямого билирубина, то прямого билирубина образуется значительно больше. Насыщенная пигментами желчь поступает в тонкий и толстый кишечник, где продуктов деградации билирубина (уробилиногена, стеркобилиногена) образуется значительно больше.
Для решения вопроса о надпеченочном характере желтухи используют комплекс клинических и лабораторных данных
Желтушность кожи и склер умеренная, кожа, как правило, бледная
Печень и селезенка могут быть увеличенными, но функция печени существенно не нарушена.
В общем анализе крови:
- анемия.
- увеличение числа ретикулоцитов. Ретикулоцитоз отражает активацию костномозговой продукции эритроцитов в ответ на их разрушение на периферии.
- ускоренный выброс из костного мозга недозрелых эритроцитов, содержащих РНК, обуславливает феномен полихроматофилии эритроцитов в фиксированных окрашенных азур-эозином мазках крови.
Биохимический анализ крови:
- уровень общего билирубина в сыворотке крови повышен;
- уровень непрямого билирубина повышен, уровень его повышения зависит от активности гемолиза и способности гепатоцитов к образованию прямого билирубина и его экскреции.
- уровень прямого билирубина (связанного) в сыворотке крови нормальный или слегка увеличен;
В моче:
- в моче повышается содержание стеркобилиногена (стеркобилинурия!), уробилиногена.
- билирубинурия отсутствует, так как через неповрежденный почечный фильтр проходит только прямой билирубин.
Кал:
- приобретает более интенсивное окрашивание.
- повышение стеркобилиногена (темная окраска).
Печеночные (паренхиматозные) желтухи
Дифференциальная диагностика печеночных желтух — один из трудных моментов врачебной практики, так как число заболеваний, протекающих с такими желтухами, достаточно велико. Причиной печеночных желтух могут быть как инфекционные, так и неинфекционные болезни.
Учитывая тот факт, что среди инфекционных болезней печеночная желтуха чаще всего обусловлена вирусными гепатитами, при проведении дифференциальной диагностики желтух, протекающих с признаками инфекционного процесса, прежде всего необходимо исключить у пациента вирусный гепатит (путем исследования специфических маркеров). В исключении острого вирусного гепатита важную роль играет сопоставление выраженности лихорадки и других проявлений общей интоксикации со степенью поражения печени.
Печеночные желтухи обусловлены поражением гепатоцитов. По ведущему механизму можно выделить несколько вариантов печеночных желтух. В одних случаях печеночная желтуха связана с нарушением экскреции и захвата билирубина, регургитацией билирубина. Это наблюдается при печеночно-клеточной желтухе, при остром и хроническом гепатитах, остром и хроническом гепатозе, циррозе печени. В других случаях нарушаются экскреция билирубина и его регургитация. Подобный тип отмечается при холестатической желтухе, холестатическом гепатите, первичном билиарном циррозе печени, идиопатическом доброкачественном возвратном холестазе, при печеночно-клеточных поражениях. В основе желтух может лежать нарушение конъюгации и захвата билирубина. Это отмечается при энзимопатической желтухе при синдромах Жильбера, Криглера — Найяра. Печеночная желтуха может быть связана с нарушением экскреции билирубина, например, при синдромах Дабина — Джонсона и Ротора.
Говоря о патогенезе отметим, что в первую очередь нарушается экскреция прямого билирубина в желчные капилляры. Частично последний поступает в кровь, повышая концентрацию общего билирубина. Прямой билирубин способен проходить через почечный фильтр, поэтому в моче определяется билирубин. Снижение содержания прямого билирубина в желчи приводит к уменьшению образования стеркобилиногена. Поскольку в больной клетке нарушается процесс конъюгации свободного билирубина, увеличивается содержание и непрямого билирубина в крови. Повреждение гепатоцитов ведет к нарушению деградации уробилиногена и он поступает в большой круг кровообращения и через почки выводится с мочой.
Для решения вопроса о печеночном характере желтухи используют комплекс клинических и лабораторных данных:
Общее состояние нарушено, симптомы интоксикации.
Желтушность кожи и склер умеренно выраженная, с оранжевым оттенком или с серым колоритом.
Печень и селезенка увеличены.
Наличие геморрагического синдрома.
Тяжесть и боль в области правого подреберья.
Неустойчивый кожный зуд.
В общем анализе крови: при вирусных гепатитах возможны лейкопения, нейтропения, относительный лимфо- и моноцитоз.
Биохимический анализ крови:
- уровень общего билирубина в сыворотке крови повышен за счет повышения прямого билирубина (связанного) и относительного повышения непрямого билирубина.
- повышение индикаторов цитолитического синдрома (повреждение гепатоцитов) – повышение АЛТ, АСТ, особенно АлАТ, коэффициент де Ритиса менее 1,33.
- увеличены показатели тимоловой пробы.
- нарушение синтетической функции печени: снижение альбуминов, фибриногена, ПТИ < 80%;
В моче:
- появляются желчные пигменты — билирубин и уробилиноген
- цвет мочи темн
 2020-09-28
2020-09-28 125
125








