Контрольные вопросы к теме 1
Условия ведения химических производственных процессов. Степень приближенности теоретических расчетов к практическим возможностям. Важнейшие поправочные условия: подготовленность сырья, фазовые состояния, обеспечение контакта, аппаратурные ограничения, экономические соображения. Обратимые и необратимые процессы. Равновесие в обратимых процессов. Принцип Ле-Шателье в химических обратимых процессах. Константа равновесия как количественная характеристика равновесия. Скорость гомогенных и гетерогенных химикотехнологических процессов. Скорости реакций и диффузионных стадий процессов. Способы определения скорости процессов. Основные формулы скорости процесса. Основные показатели химического производства: расходные коэффициенты, качество готового продукта, производительность и мощность аппаратуры, интенсивность процесса, производительность труда, себестоимость продукта. Принципы составления материального и энергетического балансов.
Тема 1.Основные закономерности ХТП
Раздел 1. Основы химической технологии
Технология (наука о ремесле) изучает способы и процессы переработки продуктов природы (сырья) в предметы потребления и средства производства.
Способ переработки есть совокупность всех операций, которые проходит сырье до получения из него готового продукта.
Способ переработки (производства) есть описание операций, протекающих в соответствующих машинах и аппаратах. Такое описание называют технологической схемой.
В основе химической технологии лежат химические, физические и физико-химические закономерности, т.е. закономерности общей, органической и физической химии, физики, механики и других химических и обще инженерных дисциплин.
Химико-технологический процесс представляет собой сумму взаимосвязанных элементарных процессов:
1. Подвод реагирующих компонентов в зону реакции;
2. Химические реакции;
3. Отвод, полученный продуктов из зоны реакции.
Подвод реагирующих компонентов в зону реакции совершается путем молекулярной диффузии или путем конвекции.
При интенсивном перемешивании компонентов конвективный перенос называют турбулентной диффузией.
Химическая технология чаще всего связана с многофазным системами. Система есть группа веществ, находящихся во взаимодействии. Фаза- совокупность однородных частей системы, одинаковых по составу, химическим и физическим свойства и ограниченных от других частей системы поверхностью раздела. В многофазных системах подвод реагирующих компонентов в зону реакции может осуществляться абсорбцией, адсорбцией, десорбцией, конденсацией паров, плавлением твердых веществ, испарением, выпаркой. Эта стадия перехода компонента из одной фазы в другую часто является наиболее медленным этапом химико-технологического процесса, и определяет общую его скорость.
Химические реакции составляют основу химико-технологического процесса.
Через ряд последовательных (иногда параллельных) химических реакций образуется готовый (основной) продукт и побочные продукты, а также отходы производства. Химико-технологический процесс усложняется в силу того, что в исходном сырье неизбежно есть примеси, которые и приводят к образованию побочных продуктов. В производственных расчетах обычно учитываются только те реакции, которые имеют определяющее влияние на качество и количество полученных основных продуктов.
Отвод полученных продуктов из. зоны осуществляется также как и подвод реагирующих компонентов, т.е. диффузией и конвекцией, которые в основном определяют переход, вещества из одной фазы в другую.
Примером сложности, многостадийности химико-технологических процессов является реакция С + O2 → CO2 + O
 ← O2
← O2
или горение колчедана
4 FeS2 +11O2 → 8 SO2 +2FeO3 +Q
Чтобы произошло химическое взаимодействие между колчеданом и кислородом, необходимо прежде всего к поверхности колчедана подвести кислород, а после того, как произошла реакция, отвести образовавшийся SO2 с поверхности колчедана. Обжиг колчедана будет распространяться внутрь, при этом кислород при проникновении к не сгоревшему колчедану FeS2 будет встречать не своем пути слой огарка, образовавшегося на поверхности колчедана, и слой инертного газа N2, содержащегося в воздухе. Образовавшийся SO2 должен преодолеть это сопротивление при выходе в объем газа. Эти процессы медленного проникновения одного веще в другое и называется диффузией.
Суммарная скорость процесса определяется скоростью вышеперечисленных элементарных стадий, которые протекают с различными скоростями. Поэтому общая скорость будет лимитироваться скоростью наиболее медленной стадии. Если наиболее медленно протекает сама химическая реакция, то процесс протекает в кинетической области.
Для ускорения таких процессов необходимо изменить факторы, влияющие на скорость химической реакции (концентрация реагирующих компонентов, температура, давление, применение катализаторов и т.д.). Если общую скорость лимитирует стадия подвода реагирующих компонентов или отвода продуктов реакции, то процесс протекает в диффузионной области. Для ускорения таких процессов стремятся увеличить диффузию (перемешивание, гомогенизация системы, повышениеt◦, и т.д.).
Знание основных закономерностей химической технологии дает возможность, установить оптимальные условия процесса, проводить его наиболее эффективно с максимальным выходом, обеспечить высокое качество продукции.
РАВНОВЕСИЕ В ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССАХ
Теоретически все реакции обратимы, т.е. могут протекать как в прямом, так и в обратном направлениях в зависимости от условий. Однако, во многих из них равновесие смещено полностью в сторону продуктов реакции и обратная реакция практически не протекает. Поэтому процессы делят на обратимые и необратимые
Обратимыми называются реакции, которые в рассматриваемых условиях могут протекать как в прямом, так и в обратном направлениях.
Химическим равновесием называется такое состояние системы, когда скорости прямой и обратной реакций равны, т.е. концентрации веществ не будут изменяться.
Ни условия равновесия наибольшее влияние оказывают изменения концентрации, температуры, давления.
Направления изменений в системе, которые могут быть вызваны перечисленными условиями, в общей форме определяются принципе Ле-Шателье:
В физико-химической системе, выведенной из состояния равновесия, происходят изменения, направленные к ослаблению воздействий выводящих систему из равновесия.
Рассмотрим применение принципа Ле-Шателье на примере реакции:
mA + nB ↔ pD + Q
где: m, n, p - стехиометрические коэффициенты;
Q - тепловой эффект реакции.
Принимаем, что реакция протекает гомогенно (в газовой фазе), а, также, что m+n > р, т.е. реакция идет с уменьшением объема.
Примером такого типа реакций может служить синтез аммиака:
3 Н2 + N2 = 2NН3 + Q
Для сдвига равновесия вправо, т.е. для повышения количеств продукта D, в соответствии с принципом Ле-Шателье необходимо понижать температуру, повышать давление, а также понижать концентрацию продукта D и повышать концентрацию исходных веществ А и В.
Согласно основному закону химической кинетики скорость прямой реакции будет:
U1 = к1 [А]m • [B]n
[А] и [B] -мольные концентрации (или парциальные давления) реагирующих компонентов;
к1 - константа скорости реакции, значение которой зависит от природы реагирующих веществ и температуры.
Скорость обратной реакции будет:
←
U2 = к2 • [D]p
По мере того, как в ходе реакции концентрация веществ А и B убывает, то скорость прямой реакции уменьшается. Увеличение концентрации вещества D в результате прямой реакции приводит к возрастанию скорости обратной реакции U2 что приведет к уравниванию скоростей прямой и обратной реакций.
→ ←
U1 = U2 или
к1 [А*]m • [B*]n = к2 • [D*]p, откуда
К=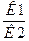
К - константа равновесия данной реакции;
[А*], [B*],[D*]- равновесные концентрации (или парциальные давления) реагирующих веществ и продуктов реакции.
Скорость технологических процессов
Скорость технологического процесса обуславливается суммарной скоростью прямой, обратной и побочных реакций, а также скоростью диффузии (подвод реагирующих веществ в зону реакции и отвод продуктов реакции).
Для ряда технологических процессов, кинетика которых еще недостаточно изучена, выход продукта является единственной мерой скорости и полноты протекания процесса. Если кинетическое уравнение (основная формула скорости) процесса известно, то для количественной оценки интенсивности работы реакторов и для технологического расчета процессов пользуются константой скорости процесса К, которая в гетерогенных процессах называется коэффициентом массопередачи.
Для гомогенных и гетерогенных процессов при неизвестной
поверхности соприкосновения согласно закону действующих
масс:
U = kVDC
или
U = kDC
Для гетерогенных процессов, т.е. при фазовом переходе веществ при известном значении F скорость процесса выражается:
U = kFDC
где: k - константа скорости процесса;
DC - движущая сила процесса;
F - поверхность соприкосновения реагирующих веществ;
V - реакционный объем.
Константа (коэффициент) скорости процесса есть сложная величина, зависящая от химических свойств реагирующих веществ, физических констант, конструкции аппарата, скорости перемешивания и т.д. Значение k можно найти в справочниках, но чаще приходится определять экспериментально.
Движущая сила процесса DC определяется для гомогенных реакций по закону действующих масс как произведение концентраций реагирующих веществ в данный момент.
Н2+ CI2 ®2HCl
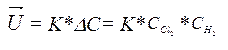
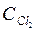 и
и 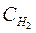 - текущие концентрации Cl и Н.
- текущие концентрации Cl и Н.
Для массопередачи в данный момент времени движущая сила процесса рассчитывается как
D С = С - С*,
где: С - действительная концентрация компонента в передающей фазе;
С*- равновесная концентрация в передающей фазе.
Конкретный вид формулы для определения движущей силы процесса во многом зависит от конструкции аппарата, от перемешивания реагирующих компонентов.
Поверхность соприкосновения взаимодействующих веществ в гетерогенной системе определяется гидродинамическими условиями процесса (перемешивание).
Способы увеличения скорости процесса.
Увеличение скорости процесса - основная задача технологии. Из формул видно, что для этого необходимо увеличивать параметры DС, F, K.
Увеличение константы скорости можно достичь тремя путями:
1) Повышение температуры сильно увеличивает константу скорости и в меньшей степени коэффициент диффузии.
2) Повышение константы скорости при помощи катализаторов.
Катализаторы ускоряют химические реакции заменой одностадийного процесса, требующие большой энергии активации, многостадийным, где требуются меньшие Е. Катализаторы не ускоряют диффузионные этапы, поэтому применяются для кинетических областей процессов.
3) Перемешивание увеличивает константу скорости процесса за счет замены молекулярной диффузии конвективной.
Поэтому перемешивание эффективно для процессов, протекающих в диффузионной области. В гомогенных процессах перемешивание выравнивает концентрации в реакционном объеме, увеличивает число столкновение реагирующих молекул.
Увеличение движущей силы процесса достигается:
1) увеличением концентрации вещества в сырье;
2) увеличением давления;
3) отводом продуктов реакции из реакционного объема;
4) смещением равновесия.
1. Дайте определение понятия «химико-технологический процесс».
2. Что называется технологическим режимом и параметрами этого режима?
3. По каким признакам классифицируются реакции, лежащие в основе ХТП?
4. Какие явления протекают в химическом реакторе?
5. Что такое движущая сила процесса? Приведите выражения для движущей силы в случае обратимых и необратимых реакций.
6. Чем определяется общая скорость химического процесса в реакторе?
7. Какие факторы влияют на скорость и равновесие химической реакции?
8. Что такое кинетическая и диффузионная области скорости процесса?
9. Что характеризует равновесная степень превращения в хим. процессе?
№1
Изменение константы равновесия реакции окисления SO2 c увеличением температуры:
- увеличивается;
- зависит от теплового режима в реакторе;
- проходит через максимум;
- проходит через минимум;
- уменьшается.
№2
Изменение равновесного содержания аммиака при понижении температуры и повышении давления в реакции
 N2 + 3H2 2NH3 + Q:
N2 + 3H2 2NH3 + Q:
- увеличивается;
- не изменяется;
- снижается;
- проходит через максимум.
 2014-02-02
2014-02-02 1433
1433







