Расчет работы расширения идеального газа в
Первый закон (начало) термодинамики является постулатом, т.е. он не может быть доказан логическим путем. Справедливость его доказывается тем, что ни одно из его следствий не противоречит опытным данным. Количественное выражение первого закона термодинамики для бесконечно малых, элементарных, процессов имеет следующий вид:
dQ = dU + dA или (1)
dU = dQ – dА (2)
Здесь d обозначает полный дифференциал и стоит перед функцией состояния.
U – внутренняя энергия (функция состояния).
dU – бесконечно малое изменение внутренней энергии системы U.
d – бесконечно малая величина (количество) какого–либо свойства, не являющегося функцией состояния системы.
dA – элементарная работа (бесконечно малое количество работы).
Формулировки первого закона термодинамики:
1. Теплота, подводимая к системе, идет на изменение внутренней энергии (функция состояния системы) и на совершение системой работы.
2. Энергия системы постоянна.
3.Энергия не исчезает бесследно и не возникает из ничего, переход её из одного вида в другой происходит в строго эквивалентных количествах.
4. Вечный двигатель 1 первого рода невозможен.
Вечный двигатель (perpetuum mobile) первого рода,такая периодически действующая машина (механизм), которая дает возможность получить работу, не затрачивая на это соответствующего количества энергии.
Элементарную работу dA обычно записывают в виде двух слагаемых:
dА = dА¢ + pdV (3)
dА¢ ‑ элементарная полезная работа,
pdV ‑ элементарная объемная работа, ее часто называют элементарной работой расширения, она относится к случаю, когда система сама совершает работу против внешнего давления. Если система совершает работу только против внешнего давления, тогда dА¢ = 0 и dА = pdV.
В общем случае выражение первого закона термодинамики в дифференциальном виде можно записать как:
dQ = dU + dА¢ + pdV (4)
Из дифференциальной формы записи первого закона путем интегрирования легко можно получить интегральную форму записи:
Q = DU + A или (5)
DU = Q – A (6)
При р = const:
Q = DU + A¢ + pDV (7)
Идеальный газ – это такой газ, молекулы которого не имеют собственного объема и не взаимодействуют между собой.
Идеальные газы подчиняются закону Менделеева-Клапейрона:
pV = nRT.
Экспериментально и теоретически показано, что внутренняя энергия идеального газа не зависит ни от объема, занимаемого газом, ни от давления, а зависит только от температуры (закон Джоуля). Иными словами, для внутренней энергии идеального газа справедливы следующие соотношения:
U ¹ f (V); 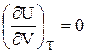 ; (8)
; (8)
U ¹ f (p); 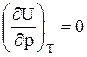 ;U = f (T). (9)
;U = f (T). (9)
Рассмотрим работу расширения dА = pdV, совершаемую одним молем идеального газа, в различных условиях:
1. Изохорный процесс Для него V = const, тогда
dV = 0, dА = 0, A = 0 (10)
2. Изобарический процесс. Для него р = const, тогда
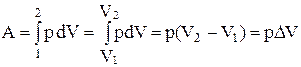 . (11)
. (11)
Но для 1 моль идеального газа выполняется уравнение Менделеева-Клапейрона pV = RT, откуда
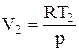 ,
, 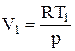 , pDV = RDT. (12)
, pDV = RDT. (12)
Поэтому получим
A = pDV= RDT=R(T2-T1) где T = 8,314 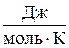 (13)
(13)
3. Изотермический процесс. Для него Т = const
dA = pdV; 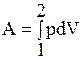 , но pV = RT, отсюда
, но pV = RT, отсюда 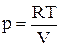 ,
,
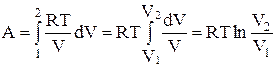 . (14)
. (14)
Но поскольку процесс изотермический, то справедлив закон Бойля – Мариотта: р1V1 = р2V2,
откуда 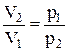 , поэтому получим
, поэтому получим
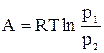 (15)
(15)
4. Адиабатический процесс. Для него dQ = 0, тогда Q = 0. В этом случае из первого закона термодинамики получаем:
dА = – dU; 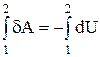 ; A = –DU = U1 – U2 (16)
; A = –DU = U1 – U2 (16)
В адиабатическом процессе работа совершается системой за счет убыли ее внутренней энергии.
(Здесь –DU = U1 – U2 – убыль внутренней энергии, DU = U2 – U1 – изменение внутренней энергии).Для n молей идеального газа работа А будет в n раз больше (если n > 1).
1.5 Теплота процессов при постоянном объеме (QV)
и постоянном давлении (Qp).
Рассмотрим химическую реакцию νАА+νВВ→νсС
Для нее dА¢ = 0, dА = рdV, тогда первый закон термодинамики в дифференциальной форме можно записать следующим образом:
dQ = dU + рdV. (17)
1). Рассмотрим изохорный процесс (V = const).
В этом случае dV = 0. Отсюда получим: dQV = dU или, интегрируя:
QV = DU.
То есть, если реакция протекает при постоянном объеме, то ее тепловой эффект QV равен изменению внутренней энергии системы в результате реакции. Однако, поскольку внутренняя энергия есть функция состояния системы, то QV приобретает свойства является функции состояния системы.
2). Рассмотрим изобарный процесс (р = const).
Тогда рdV = d(pV);
dQр = dU + d(pV) = d(U+ pV) (18)
Под знаком дифференциала стоит некоторая функция состояния. Обозначим ее через Н = U + pV (19)
и назовем энтальпией.
Тогда получим:
dQр = dН, Qр = DН.
Таким образом, тепловой эффект реакции, протекающей при постоянном давлении, равен изменению энтальпии DН и обладает свойствами функции состояния.
 2014-02-02
2014-02-02 3341
3341








