Равновесные термодинамические процессы удобно изучать и сравнивать друг с другом, используя их графическое изображение. Для этого строят 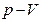 ,
, 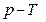 и
и 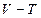 диаграммы. На
диаграммы. На 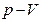 диаграмме, приведенной на рис.3.2, точки
диаграмме, приведенной на рис.3.2, точки  и
и 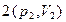 характеризуют
характеризуют
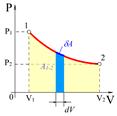 Рис.3.2 Рис.3.2 | начальное и конечное состояния системы, Термодинамический процесс изображается кривой  . Элементарная работа . Элементарная работа 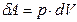 определяется площадью узкой голубой полоски на рисунке. Работа, совершаемая системой в процессе определяется площадью узкой голубой полоски на рисунке. Работа, совершаемая системой в процессе 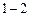 , равная , равная  , измеряется площадью под кривой , измеряется площадью под кривой  .Из рисунка видно, что величина работы .Из рисунка видно, что величина работы 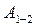 зависит от того, каким образом система переходит из начального состояния в конечное, т. е. от вида процесса зависит от того, каким образом система переходит из начального состояния в конечное, т. е. от вида процесса  . . |
3.5. Теплоемкость вещества
Одной из основных характеристик, описывающих тепловые свойства вещества, является его теплоемкость 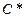 – физическая величина, определяемая количеством теплоты
– физическая величина, определяемая количеством теплоты 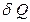 , которое необходимо подвести к веществу или отнять от него для изменения его температуры на
, которое необходимо подвести к веществу или отнять от него для изменения его температуры на 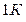 :
: 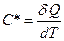 (2.3.6)
(2.3.6)
Теплоемкость вещества зависит от его массы, химического состава, термодинамического состояния, а также от вида процесса передачи ему теплоты  . Различают удельную (
. Различают удельную ( ) и молярную (
) и молярную ( ) теплоемкости. Это теплоемкости единицы массы вещества и 1 моля вещества:
) теплоемкости. Это теплоемкости единицы массы вещества и 1 моля вещества:
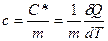 и
и 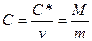
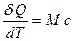 , (2.3.7)
, (2.3.7)
где 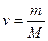 – количество вещества;
– количество вещества; 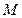 – молярная масса вещества.
– молярная масса вещества.
Откуда 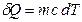
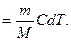 (2.3.8)
(2.3.8)
Единицы удельной и молярной теплоемкостей – 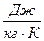 и
и  .
.
Различают теплоемкость 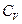 при постоянном объеме и теплоемкость
при постоянном объеме и теплоемкость 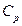 при постоянном давлении.
при постоянном давлении.
 2014-02-02
2014-02-02 2176
2176








