Таблица 38
 |
Патология гемостаза
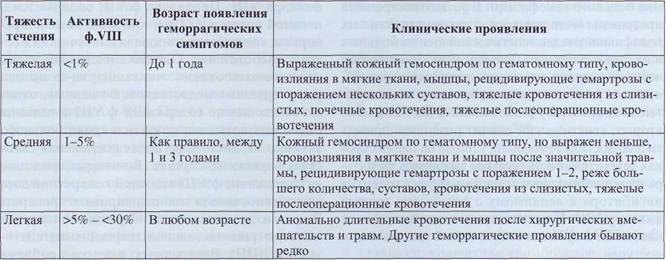
При тяжелой форме гемофилии А активность ф.VIII в крови практически не меняется в течение жизни. При среднетяжелой - возможны колебания в незначительных пределах, а при легкой форме активность фактора может изменяться, в том числе повышаться, особенно при применении синтетических аналогов ва-зопрессина.
Генетика гемофилии А. Врожденная гемофилия А обусловлена дефектами в Х-хромосо-ме, в которой ген, определяющий синтез фактора VIII, составляет фрагмент 0,1% массы хромосомы. Во фрагменте ДНК в 9 Kb кодируется последовательность из 2351 аминокислоты, различные мутации этого фрагмента, включая де-леции, дубликации, замены, могут вызывать гемофилию А. У женщины-носителя гена гемофилии есть 25 шансов из 100 родить дочь-носителя гена гемофилии и 50 из 100 - родить здорового мальчика или девочку, не являющуюся носителем гена гемофилии.
Семейный анамнез. По данным Всемирной федерации гемофилии 2/3 больных гемофилией имеют в семейном анамнезе данные за геморрагическую коагулопатию, а у трети - нарушения выявляются впервые. Анализ, проведенный в гематологическом центре Измайловской ДГКБ г. Москвы, показал другие результаты: среди семей, в которых есть дети, больные гемофилией, лишь около 1/3 до момента рождения больного ребенка знали о наличии геморрагических проявлений у членов семьи.
Анализ ДНК гена фактора VIII в настоящее время является важной частью обследования семьи больного гемофилией. В развитых странах в программы медицинского страхования больных гемофилией введен генетический анализ больных и их семей, что имеет большое практическое значение. Во-первых, это позволяет проводить семейную консультацию с оценкой риска рождения детей с гемофилией у родственников больного. Во-вторых, генетический анализ позволяет провести диагностику гемофилии у плода на ранних сроках беременности. В-третьих, выяснение характера мутации позволяет предсказать риск развития ингибитора к вводимому с лечебными целями фактору VIII. К сожалению, в нашей стране до настоящего времени генетический анализ малодоступен.
Клинические проявления гемофилии А
Для гемофилии А характерны отсроченные кровотечения и кровоизлияния, возникающие после травмы. Поскольку при гемофилии не страдает первичный тромбоцитарный гемостаз, при травмах сосудов небольшого калибра кровотечения останавливаются. Однако аномально длительный процесс свертывания крови не позволяет создать своевременно плотный тромб, что приводит к рецидиву кровотечения. В зависимости от тяжести гемофилии без адекватного лечения вторичное кровотечение может остановиться через некоторое время, но может длиться очень долго, приводя к тяжелой анемии. Очень характерным для гемофилии является кровоизлияние в элементы опорно-двигательного аппарата. Гематомы мышц и рецидивирующие кровоизлияния в суставы приводят этих больных к нарастающему остеопорозу, мышечной дистрофии, артрозам крупных суставов. Значительное поражение опорно-двигательного аппарата у неправильно леченных пациентов с тяжелой гемофилией А формируется к младшему школьному возрасту.
Наиболее значимыми осложнениями гемофилии являются поражение опорно-двигательного аппарата, хроническая постгеморрагическая (железодефицитная) анемия. У пациентов, имевших в анамнезе внутричерепные кровоизлияния, выявляется остаточная неврологическая симптоматика.
Лечение гемофилии
Основным патогенетическим методом лечения гемофилии А является введение препаратов фактора VIII. Поскольку ф.VII содержится в цельной крови и плазме, это были первые препараты, которые использовали для остановки острых кровотечений. Однако в настоящее время от их использования отказались из-за целого ряда серьезных недостатков. Во-первых, относительно низкое содержание ф.VIII в единице объема не позволяет создать в крови больного активность, достаточную для достижения гемостаза в сложных случаях. Во-вторых, поскольку содержание ф.VIII в каждой конкретной дозе неизвестно, нельзя точно дозировать препарат. В-третьих, имеется высокий риск инфицирования гемотрансмиссивными инфекциями (гепатитами и ВИЧ). В-четвертых, имеется проблема
Патология гемостаза
хранения. Цельная кровь и плазма могут храниться только при температурах ниже -20 °С ограниченное время, что исключает их применение вне больницы. В-пятых, при частом применении возрастает число аллергических и анафилактических реакций.
Препаратом следующего поколения стал кри-опреципитат - осажденная при +4 °С часть плазмы, содержащая большое количество ф.VIII, фибриногена и ф.ХIII. По сравнению с кровью и плазмой криопреципитат содержит большее количество ф.VIII на единицу объема, что позволяет останавливать кровотечения даже при некоторых хирургических вмешательствах. Однако в остальном криопреципитат обладает теми же недостатками. В качестве гемостатического препарата при гемофилии А в развитых странах он практически не применяется.
Революционным шагом стала разработка высокоочищенных препаратов ф.VIII. Это позволило создать препараты с высокой активностью ф.VIII в малом объеме, что решило проблему достижения любой необходимой концентрации ф.VIII в крови реципиента. К тому же разработанные методы удаления вирусов позволили свести на нет риск заражения наиболее значимыми инфекциями, передающимися через кровь, - ВИЧ, гепатитами В и С. Современные препараты концентратов ф.VIII представляют собой лиофилизированный порошок с точно определенной активностью ф.VIII. Препарат может храниться при комнатной температуре до 6 месяцев, а при +2... +8 °С - до 2 лет, что позволяет легко использовать его в домашних условиях. Однако такие препараты стоят дорого. Создание концентратов ф.VIII сделало возможным их профилактическое введение для предотвращения кровоизлияний в суставы. В настоящее время разработано четвертое поколение ан-тигемофильных препаратов - концентраты ре-комбинантного ф.VIII. При их производстве вообще не применяются компоненты крови человека, что теоретически полностью исключает риск инфицирования гемотрансмиссивными вирусами. К сожалению, стоимость этих препаратов значительно выше, чем препаратов производных человеческой плазмы.
Современные подходы к лечению гемофилии, с учетом стоимости гемостатических препаратов,
требуют регулярного контроля состояния гемостаза с обязательным определением активности дефицитного фактора.
Ингибиторная форма гемофилии А
Наиболее значимым специфическим осложнением терапии препаратами ф.VIII является развитие ингибиторной формы гемофилии. Примерно у 5-20% пациентов с тяжелой формой гемофилии А, получавших препараты ф.VIII, в крови появляются антитела к нему. При высоком титре антител весь вводимый препарат немедленно связывается и выводится из кровотока. Это создает значительные трудности при оказании гемостатической помощи. С практической точки зрения необходимо знать активность развившегося ингибитора. Активность измеряется методом Бетезда (см. ниже) в Бетезда единицах (БЕ). При титре ингибитора до 5 БЕ возможно лечение высокими дозами концентрата ф.VIII. При титре более 5 БЕ необходимы другие пути решения проблемы.
В настоящее время для оказания гемостатической помощи пациентам с ингибиторной формой гемофилии применяются препараты, позволяющие запустить коагуляционный каскад «ниже» факторов VIII и IX. Наиболее часто применяются препараты FEIBA и NovoSeven.
FEIBA - активированный концентрат факторов протромбинового комплекса. В его состав входят факторы IX, X, VIIa. Его внутривенное введение активирует образование протромбиназ-ного комплекса.
NovoSeven - концентрат рекомбинантного активированного фактора VII. В основе механизма гемостатического действия этого препарата лежит значительная активация первого этапа внешнего каскада, происходящая при контакте ТФ и ф.VIIа. Кроме того, этот препарат в терапевтических концентрациях способен активировать ф.IХ и ф.Х на мембране активированных тромбоцитов без участия ТФ.
Диагностический алгоритм гемофилии представлен в табл. 39:
• На первом этапе выполняются скрининговые тесты: время кровотечения, ПВ, АЧТВ, фибриноген, количество тромбоцитов.
Патология гемостаза
Таблица 39
Изменение коагулограммы при заболеваниях, сопровождающихся геморрагиями
 |
• На втором этапе выполняются уточняющие
тесты.
• После выявления удлинения АЧТВ и сниже
ния активности ф.УШ проводится тест сме
шивания. Плазма пациента смешивается с
нормальной контрольной плазмой (100% ак
тивности факторов) в соотношении 1:1.
АЧТВ и активность ф.УШ определяются не
медленно и после инкубации в течение часа
при 37 °С. Если активность ф.УШ в обоих
тестах равна 50%, данных за ингибитор нет.
Если активность достоверно ниже 50% только
в инкубированной пробе, имеются данные за
наличие специфического ингибитора к ф.УШ.
Если активность снижается в обеих пробах
(при исследовании сразу после смешивания
и после часовой инкубации), можно заподоз
рить наличие волчаночного антикоагулянта.
• При наличии признаков специфического ин
гибитора на этапе первичной диагностики
или при контрольном обследовании показа
но проведение исследования титра ингибито
ра по методу Бетезда.
Контроль терапии
Поскольку специфическая терапия гемофилии предусматривает введение препаратов фактора VIII, важно знать, какой уровень фактически достигается после их введения. Эта необходимость возникает при использовании препаратов с опре-
деленной активностью фактора, поскольку каждый пациент имеет индивидуальные особенности распределения и метаболизма факторов свертывания. Необходимость контроля может быть связана с недостаточной эффективностью препарата в период оперативного лечения или после травмы, поскольку при активной кровопотере или большой раневой поверхности потребление факторов свертывания существенно усиливается. В ряде случаев достаточно проводить однократное определение активности, но для большей точности дозирования дорогостоящих препаратов более надежный способ - это проведение теста восстановления активности ф.VIII после введения известной дозы препарата. Тест описан ниже.
Исследование активности ингибитора по методу Бетезда
За 1 единицу Бетезда (БЕ) принято такое количество антител, которое блокирует 50% активности фактора в контрольной плазме. Метод основан на тесте смешивания. Плазма пациента последовательно разводится до концентрации, которая блокирует 50% или менее активности фактора в контрольной плазме, после чего, зная степень разведения плазмы пациента, можно вычислить активность ингибитора. Для большей точности желательно учитывать результаты 2-3 последовательных разведений и вычислять среднее арифметическое.
Патология гемостаза
Пример. У пациента с подозрением на инги-биторную форму гемофилии активность ф.УШ в результатах тестов смешивания следующая (табл. 40).
Вычисляем по данным табл. 40. Разведение плазмы пациента 1/16 блокирует 20% активности ф.УШ в контрольной плазме (50 - 30). Вычисляем, что разведение, которое блокирует 50%, составит 1/6,4. Разведение 1/8 блокирует 41% активности фактора VIII (50 - 9), разведение, которое блокирует 50%, будет равно 1/6,6. Так же для разведения 1/32 разведение, блокирующее 50%, составит 1/5,1. Среднее арифметическое из полученных 3 результатов будет примерно равно 1/6. Таким образом, 50% активности ф.VIII блокируется плазмой пациента в разведении 1:6, т. е. активность ингибитора в плазме больного составляет 6 БЕ.
Данный метод применим для исследования активности специфического ингибитора к любому фактору свертывания.
 2014-02-17
2014-02-17 8116
8116
