1. Законы Коновалова.
2. Криоскопия, эбулиоскопия, осмос.
3. Закон распределения компонента между двумя жидкостями. Экстракция, ее использование в производстве.
Так как по закону Рауля для обоих компонентов двухкомпонентного раствора имеем:
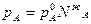 и
и 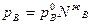
то отсюда можем  записать:
записать:

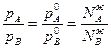
поделив числитель и знаменатель левой части на общее давление пара Р=РА+РВ
получим:

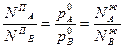
где индексом П обозначена паровая фаза.
Из этих соотношений видно, что составы жидкой и паровой фазы в идеальных системах будут одинаковы только лишь тогда, когда давление насыщенного пара над компонентом А будет равно давлению насыщенного пара над компонентом В, т.е. когда:

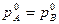
в противном случае пар будет обогащен более летучим компонентом:
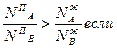 РA>PB
РA>PB
Этот факт отражен в первом законе Коновалова (1881):
 Насыщенный пар по сравнению с равновесным раствором относительно богаче тем компонентом, добавление которого к системе повышает общее давление пара (или снижает температуру кипения раствора)
Насыщенный пар по сравнению с равновесным раствором относительно богаче тем компонентом, добавление которого к системе повышает общее давление пара (или снижает температуру кипения раствора)
 |
Первый закон справедлив не только для идеальных раствовров, но и для растворов, имеющих отклонения от закона Рауля.
На различиях в составах раствора и равновесного с ним пара основан метод разделения смесей посредством ректификации.
В соответствии с диаграммой состав- температура частичное испарение раствора приведет к обогащению паровой фазы более летучим компонентом, а жидкость – менее летучим. Если жидкость отделить от пара и опять частично испарять, то жидкий остаток еще сильнее обогатится менее летучим компонентом. Повторяя такие операции, можно в конце получить практически чистый менее летучий компонент. Такой способ перегонки называют простой перегонкой.
Если пар конденсируют и потом присоединяют к жидкой фазе предыдущей смеси, то получают большой выигрыш в количестве получаемого чистого вещества.
Ректификацию применяют, если не требуется полного разделения смеси на чистые компоненты, а в целях очистки, например, в спиртовом производстве.
Ректификация применяется тогда, когда температуры испарения (кипения) компонентов сильно различаются.
Аналогично, проводя частичную конденсацию пара и отбрасывая жидкость, можно получить после ряда таких операций практически чистый более летучий компонент. Этот процесс носит название фракционной перегонки.
При образовании растворов с положительными от клонениями от закона Рауля происходит поглощение теплоты, что облегчает процесс испарения. Поэтому давление пара над системой оказывается большим, чем вычисленное по закону Рауля. Положительные отклонения характерны для большинства гомогенных растворов. Например, ацетон-бензол, ацетон-вода, бензол-четыреххлористый углерод.
Образование растворов с отрицательными отклонениями от закона Рауля встречаются значительно реже. Оно сопровождается выделением теплоты, что затрудняет процесс испарения и давление насыщенного пара оказывается меньше, чем рассчитанное по закону Рауля.
Для некоторых систем отклонения эти так велики, что на кривой зависимости общего давления от состава раствора появляются точки, значения которых гораздо выше, чем давление пара чистого более летучего компонента при положительных отклонениях или меньше, чем менее летучего компонента при отрицательных отклонениях..
В точках, соответствующих максимуму или минимуму состав пара совпадает с составом жидкости. Такие точки называют азеотропными. Для них применим второй закон Коновалова:
Максимум на кривой общего давления соответствует минимум на кривой температур кипения и отвечает такому равновесию раствора и его насыщенного пара, при котором составы обеих фаз одинаковы.
Раствор, характеризующийся экстремальными точками на диаграммах, получил название азеотропного или нераздельно кипящего. Он кипит при постоянной температуре не изменяя своего состава. Но если только изменить внешнее давление, изменится не только температура кипения раствора, но иего состав. Это говорит о том, что азеотроп является не химическим соединением.
Чаще всего встречаются азеотропные смеси с минимальной температурой кипения. К ним относятся вода- этиловый спирт, метиловый спирт-ацетон, бензол- уксусная кислота.
Азеотропы с максимумом температуры кипения встречаются реже. К ним относятся водные растворы кислот (серной, соляной, муравьиной и т.д.).
Азеотропные смеси разделить на чистые компоненты при постоянном давлении нельзя. В итоге получается всегда один чистый компонент и азеотропная смесь. Так, например, 96%-ный спирт и вода. В чистом виде всегда будет выделяться тот компонент, содержание которого больше в исходной смеси по сравнению с азеотропной.
Коллигативные свойства растворов.
Свойства раствора, которые не зависят от природы растворенного вещества, а определяются только количеством частиц в растворе, называются коллигативными
К коллигативным свойствам относят
§ повышение осмотического давления раствора,
§ повышение температуры кипения раствора,
§ понижение давления насыщенного пара растворителя над раствором,
§ понижение температуры замерзания растворов.
На рис. представлены температурные зависимости давления насыщенного пара растворителя над растворителем(3) и насыщенного пара растворителя над растворами (1 и 2). При этом Х1>X2>X3 (концентрация растворителя). Кипение наступает при равенстве давления насыщенного пара над жидкостью и внешнего давления.
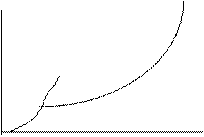 |
Чтобы найти температуры кипения чистого растворителя и растворов, нужно найти точки пересечения изобары при атмосферном давлении и опустить перпендикуляры на ось абсцисс.
Найденные таким образом температуры кипения указывают на то, что раствор кипит при более высокой температуре, чем чистый растворитель: Тк3>Tк2>Tк1.
Разность температур кипения раствора и растворителя называют повышением температуры кипения раствора ΔТкип. Чем выше концентрация раствора, тем выше температура кипения.
Количественное соотношение между ΔТкип и моляльной концентрацией получают из уравнения Клапейрона-Клаузиса:
ΔTкип=Кэ m
где к – эбуллиоскопическая константа растворителя. Она численно равна повышению температуры кипения раствора, содержащего 1 моль растворенного вещества в 1000 г растворителя.
Температурой замерзания жидкости является такая температура, при которой давление насыщенного пара над кристаллами льда и над жидкостью одинаково.
Чтобы определить точки замерзания растворителя и растворов 1,2,3, нужно найти точки пересечения кривой температурной зависимости давления насыщенного пара растворителя над твердой фазой и опустить перпендикуляры на ось абсцисс. Это точки Тз1< Тз2< Тз3.
Чем больше концентрация раствора, тем ниже температура его замерзания.
Разность температур замерзания растворителя и раствора называется понижением температуры замерзания раствора.
Аналогично повышению температуры кипения вывод количественного соотношения между понижением температуры замерзания раствора и его концентрацией получают из уравнения Клапейрона-Клаузиса (самост-но):
ΔTз=Кз m
где Кз – криоскопическая константа, она численно равна понижению температуры замерзания одномоляльного раствора при условии, что раствор остается идеальным, а растворенное вещество не ассоциирует и не диссоциирует.
Расчет молярной массы при использовании криоскопического метода производят по формуле:
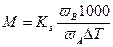
Образование любого раствора является процессом диффузии растворенного вещества в растворителе и связано с явлением осмоса.
Пусть раствор и чистый растворитель разделены мембраной, пропускающей молекулы растворителя и не пропускающей молекулы растворенного вещества. Такая мембрана называется полупроницаемой.
Химический потенциал растворителя в чистом растворителе больше, чем его потенциал в растворе. Поэтому в системе начнется процесс выравнивания этих потенциалов. Растворитель будет переходить через мембрану в раствор, что приведет к разбавлению раствора. Такое явление, получившее название осмос, впервые описал аббат Нолле в 1748г.
Процесс односторонней диффузии растворителя через полупроницаемую перегородку из раствора с меньшей концентрацией растворенного вещества в раствор с большей концентрацией называется осмосом.
Проникновение растворителя в раствор и разбавление раствора можно предотвратить, если к нему приложить давление.
Давление, которое необходимо приложить к раствору для предотвращения осмоса, т.е. для приведения системы в состояние равновесия, называется осмотическим давлением.
Осмотическое давление не зависит от природы вещества и от природы мембраны, а зависит только от концентрации раствора.
Анализируя результаты изучения осмотического давления растворов сахара разной концентрации, Вант-Гофф в 1887 г. пришел к выводу, что растворенное вещество ведет себя в разбавленном растворе подобно идеальному газу, а если так, то к нему можно применить уравнение состояния идеального газа:
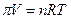
где пи – осмотическое давление, V – объем разбавленного раствора, л, n –число молей растворенного вещества.
Решив уравнение относительно пи и заменив n/V на с, получим уравнение, известное как закон Вант-Гоффа:
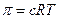
где с – концентрация растворенного вещества, моль/л.
Часто рассчитанное аналитически осмотическое давление отличается от наблюдаемого экспериментально. Это связано с ассоциацией или диссоциацией частиц. Отношение экспериментально определенного осмотического давления к рассчитанному по закону Вант-Гоффа называется изотоническим коэффициентом:
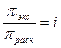
для электролитов i >1, т.к. происходит увеличение числа частиц растворенного вещества.
4. Закон распределения компонента между двумя жидкостями. Экстракция, ее использование в производстве.
Если к смеси двух несмешивающихся или ограниченно смешивающихся жидкостей прибавить некоторое количество вещества, растворенного в обоих жидкостях, то оно распределяется между обоими слоями определенным образом.
Если этого вещества мало, то коэффициент распределения (отношение концентраций вещества в обеих фазах) есть величина постоянная.
В 1872 г. Бертло и Юнгфлейшем установили это эмпирически на опытах распределения галогенов между водой и сероуглеродом.
Позже, в 1890 году Нернст определил, что
Распределение каждого из растворенных веществ между двумя фазами определяется индивидуальным коэффициентом распределения, величина которого не зависит от присутствия других веществ.
Закон распределения третьего компонента между двумя несмешивающимися жидкостями можно вывести термодинамически из фазового равновесия.
Для распределяемого вещества между фазами 1 и II при постоянной температуре должно выполняться равенство:
μ1=μII т.е.
равновесие растворенного вещества между двумя несмешивающимися жидкостями характеризуется равенством их химических потенциалов
Отсюда: 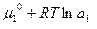 =
=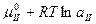
где a активности вещества в первом и втором компоненте.
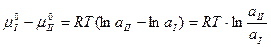 или
или 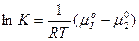
где 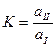
Т.е. отсюда следует, что отношение активностей растворенного вещества при равновесном распределении его между двумя несмешивающимися жидкостями при постоянной температуре есть величина постоянная.
Если в выражение Термодинамической константы распределения вместо активности поставить ее выражение через коэффициент активности и концентрацию компонента, то получим:
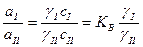
Отношение равновесных концентраций в двух несмешивающихся жидкостях при постоянной температуре называется коэффициентом распределения.
Коэффициент распределения Кd в отличие от термодинамической константы распределения K зависит не только от температуры и природы компонентов системы, но и от ионной силы раствора, так как от последней зависят коэффициенты активности.
Для разбавленных растворов С →0, γ→1, γ→1, и Кд→К
Условно принято выражать коэффициент распределения отношением равновесной концентрации распределяемого вещества в органической фазе к его концентрации в водной фазе:
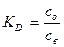
Нернст и Шилов установили, что закон распределения в формулах, приведенных выше, применим в тех случаях, когда распределяемое вещество в каждой из равновесных фаз находится в одинаковом молекулярном состоянии.
Если же молекулы растворенного вещества во втором растворителе ассоциированы или диссоциированы, устанавливается сложное равновесие между простыми или ассоциированными ионами или молекулами в пределах каждой фазы.
Для этих случаев закон распределения можно выразить уравнением:
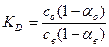
где a – степень диссоциации в органической и водной среде.
На распределении вещества между двумя несмешивающимися растворителями основан метод экстракции.
Экстракцией называется извлечение растворенного вещества из раствора при помощи другого растворителя (экстрагента), практически несмешивающегося с первым.
(Стромберг, стр.206)
 2014-02-09
2014-02-09 2717
2717
