Общая характеристика растворов. Идеальные, разбавленные, реальные растворы.
Растворами называют гомогенные термодинамически устойчивые системы состоящие из двух и более компонентов.
Различают газообразные. жидкие и твердые растворы. Газообразные – это смеси газов, жидкие- это смеси жидкостей или газообразных веществ и твердых веществ, растворенных в жидкостях, и твердые растворы представляют собой твердые фазы, получающиеся при охлаждении жидких расплавов.
С точки зрения термодинамики все компоненты раствора являются равноценными, но в растворе растворителем считается тот компонент, который находится изначально в избытке.
От химических соединений растворы отличаются тем, что их состав может меняться непрерывно в определенных пределах, при это его основные свойства сохраняются.
Важнейшей характеристикой раствора являются его состав и концентрация компонентов.
Массу компонента, приходящуюся на единицу массы раствора, называют массовой концентрацией компонента. выражается в %.

Число молей компонента, отнесенное к общему числу молей всех компонентов раствора, называют мольной (молярной) долей компонента:
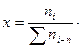
Число молей компонента, приходящееся на единицу объема раствора, называют его молярной концентрацией, или его молярностью, выражают в молях на литр:
с = n/ V моль/л.
Число молей компонента, приходящееся на 1000г растворителя – его моляльная концентрация. Применяют тогда, когда реакция идет в неизотермических условиях. m= n / m, моль,/ кг
Все растворы разделяют на идеальные, предельно разбавленные и неидеальные, или реальные растворы.
В растворе можно выделить три разных типа взаимодействия:
а) между частицами растворителя,
б) частиц растворенного вещества с частицами растворителя,
в) между частицами растворенного вещества.
Первые два типа характерны для любого раствора, без них существование раствора немыслимо. Третий тип имеется лишь при высокой концентрации растворенного вещества. В разбавленных растворах, при низкой концентрации растворенного вещества частицы его практически не встречаются друг с другом, поэтому взаимодействие их между собой не оказывает влияния на многие свойства раствора в целом. Поэтому многие закономерности поведения таких растворов существенно проще.
В связи с этим в физхимии используется понятие предельно разбавленный раствор, т.е. тот раствор, в котором можно пренебречь взаимодействием частиц растворенного вещества между собой. Это понятие идентично понятию идеального газа.
По мере возрастания концентрации растворенного вещества простые закономерности, характерные для предельно разбавленных растворов, начинают искажаться, так как появляется новый тип взаимодействия – взаимодействие между частицами растворенного вещества
Но эти взаимодействия не резко отличаются от тех, которые существовали при низких концентрациях.
Растворы, образованные компонентами, у которых силы взаимодействия между однородными и разнородными молекулами одинаковы, а свойства отдельных компонентов не отличаются от их свойств в чистом индивидуальном виде, называются идеальными.
Т.Е. раствор, в котором ЕАА=ЕВВ=ЕАВ должен получаться при смешении веществ, которые мало отличаются друг от друга по физико-химическим свойствам. (Изомеры, смеси изотопов, соседних гомологов в ряду органических соединений, органич. в-ва, отличающиеся замещенными функциональными группировками ит.д.).
А если так, то для таких растворов должно выполняться условие аддитивности.
1)Т.е. внутренняя энергия этого раствора должна быть равна сумме внутренних энергий его компонентов:
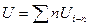 , или ΔU mix =0
, или ΔU mix =0
другими словами, образование идеального раствора не должно сопровождаться тепловым эффектом,
2) Объем идеального раствора равен сумме объемов смешиваемых компонентов:
 V=
V=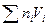 т.е. объем идеального раствора равен объему смешиваемых компонентов и ΔV mix =0,
т.е. объем идеального раствора равен объему смешиваемых компонентов и ΔV mix =0,
3) Энтропия смешения для идеальных растворов равна изменению энтропии при смешении идеальных газов, так как из=за одинаковой энергии взаимодействия между молекулами их распространение в растворе будет равномерным и не будет отличаться от распространения молекул газа в пространстве. т.е. энтропия будет изменяться одинаково:
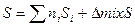
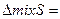
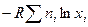
Поскольку свойства идеальных растворов просты, их аддитивное поведение описывается законами Рауля и, Вант- Гоффа которые называются законами идеальных растворов.
Закон Рауля
Опыт показывает, что при растворении в данном растворителе какого-нибудь вещества равновесное давление пара растворителя понижается.
Количественную связь между понижением давления пара и составом раствора открыл в 1887 году Ф.Рауль.
Пусть жидкость при некоторой температуре имеет давление насыщенного пара рА0. При растворении в ней вещества В давление насыщенного пара растворителя понизится и станет равным pА.
Уменьшение давления пара вызвано тем, что число молекул растворителя, находящихся в паровой фазе, уменьшилось, так как мольная доля растворителя А в растворе понизилась – была 1, а стала 1- nB, где nB– мольная доля растворенного компонента В. А так как раствор идеален по условию, то сила взаимодействия молекул А-А и В-А В-В одинакова. Поэтому число молекул, перешедших в пар, изменится пропорционально понижению молярной доли вещества А в растворе и тогда относительное понижение давления пара растворителя над раствором равно мольной доле растворенного вещества в жидкости:

Если это уравнение решить относительно рА, то получим: 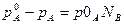
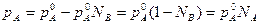
Т.е. давление пара растворителя над раствором прямо пропорционально мольной доле растворителя в растворе. Причем коэффициентом пропорциональности является давление насыщенного пара над чистым растворителем при данной температуре.
Это вторая формулировка закона Рауля.
Если идеальный раствор состоит из двух летучих компонентов, то закон Рауля будет справедлив как для растворителя, так и для растворенного вещества:
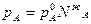 и
и 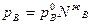
Из уравнений следует, что парциальное давление каждого компонента является линейной функцией его молярной доли в растворе.
Это отобразится на графике прямыми
Для бинарного раствора, по закону Дальтона,
р=рА+рВ
или р=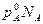 +
+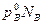
а с учетом того, что NA +NB=1 имеем: р=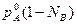 +
+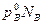
после преобразований:: р=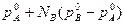
Т.Е. при постоянной температуре давление пара над идеальным жидким раствором является линейной функцией концентрации раствора.





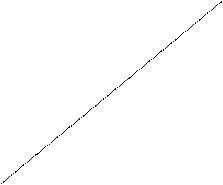
 Зависимость общего давления пара и парциальных давлений пара отдельных компонентов от состава идеального раствора изобразится графиком:
Зависимость общего давления пара и парциальных давлений пара отдельных компонентов от состава идеального раствора изобразится графиком:
Неидеальными, или реальными растворами называют растворы, у которых сила взаимодействия между однородными и разнородными молекулами неодинаковы.
Реальные растворы не подчиняются законам идеальных растворов. отклонения от этих законов могут быть положительными и отрицательными.
Если давление пара над реальным раствором больше, чем над идеальным раствором того же состава, то это отклонение от закона Рауля считают положительным. И наоборот, если меньше – отрицательным.
Положительные отклонения возникают в том случае, если энергия взаимодействия разноименных молекул (А-В) меньше, чем одноименных (А-А, В-В). В этом случае сила взаимодействия молекул в растворе меньше и они легче переходят в пар.


 Отрицательные отклонения от закона Рауля наблюдаются тогда, когда сила взаимодействия между одноименными молекулами больше, чем между разнородными.
Отрицательные отклонения от закона Рауля наблюдаются тогда, когда сила взаимодействия между одноименными молекулами больше, чем между разнородными.







 В реальных растворах отношение истинного значения парциального давления компонента к рассчитанному по закону Рауля называют активностью компонента:
В реальных растворах отношение истинного значения парциального давления компонента к рассчитанному по закону Рауля называют активностью компонента:
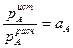
В случае положительного отклонения от закона Рауля а>1, в случае отрицательного а<1.
Активностью компонента а раствора называется термодинамическая величина, подстановка которой вместо концентрации в формулу химического потенциала компонента идеального раствора делает ее справедливой для реального раствора:
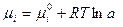
Отношение активности компонента к его концентрации носитназвание коэффициента активности:
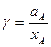
Неидеальные растворы образуются с выделением или поглощением теплоты и изменением объема и теплоемкости, поэтому для неидеальных растворов
ΔН=/=0 и ΔV=/=0
Разность между функциями смешения идеальных растворов и реальных растворов носит название избыточных функций.
* Экспериментально установлено, что при растворении газов в жидкостях выполняется закон Генри:
растворимость газа в жидкости при посмтоянной температуре пропорциональна давлению газа:
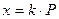
где К – постоянная для данных условий величина.
Закон Генри справедлив для малоконцентрированных растворов. С ростом х проявляются все большие отклонения от него.
 2014-02-09
2014-02-09 5215
5215
