Для анализа фазовых превращений широко используются правило фаз и правило отрезков.
Правило фаз (закон Гиббса) описывается уравнением: С = К – Ф + 2, где
С – число степеней свободы системы – число внутренних (концентрация) и внешних факторов (температура и давление), которое можно изменять без изменения числа фаз в системе;
К – число компонентов (химических элементов), образующих систему. Иногда в качестве компонентов удобно использовать не химические элементы, а их соединения, например, Fe 3 C, тогда их называют псевдокомпонентами;
Ф – число фаз, находящихся в равновесии;
2 – число внешних факторов (температура и давление).
Многие металлургические процессы проходят при постоянном давлении, чаще всего, атмосферном. В этом случае правило фаз упрощается: С = К – Ф + 1.
Продемонстрируем применение правила фаз для объяснения различного поведения кривых охлаждения чистых компонентов и сплавов на рис. 24.1 а, приняв давление постоянным.
На кривой охлаждения А имеется 3 участка:
- на участке А–t А существует только однокомпонентная жидкость, поэтому С=1–1+1=1, т.е. существует одна степень свободы, которая реализуется на снижение температуры;
- при температуре кристаллизации t А в равновесии находятся жидкая и твердая фазы, поэтому С=1–2+1=0 и система не может изменять температуру пока вся жидкость не затвердеет, т.е. не станет однофазной;
- при температуре ниже t А существует только одна твердая фаза, поэтому С=1–1+1=1 и система получает возможность дальнейшего охлаждения до комнатной температуры.
На кривой охлаждения 1 также имеется 3 участка:
- на участке 1–t 1 существует только двухкомпонентная жидкость, поэтому С=2–1+1=2, т.е. существует две степени свободы, одна из которых реализуется на снижение температуры;
- на участке t 1– t 2 в равновесии находятся жидкая и твердая фазы переменного состава, поэтому С=2–2+1=1 и система может продолжать кристаллизоваться с одновременным снижением температуры;
- при температуре ниже t 2 существует только одна твердая фаза, поэтому С=2–1+1=2 и полученный сплав компонентов А и В имеет возможность дальнейшего охлаждения до комнатной температуры.
Правило отрезков (правило рычага) позволяет определить химический состав фаз, находящихся в равновесии и соотношение между этими фазами.
Рассмотрим охлаждение двухкомпонентного сплава, содержащего 25 % В + 75 % А, – см. сечение К на рис 25.
Чтобы определить химический состав в любой точке а двухфазной области необходимо через выбранную точку а провести горизонталь до пересечения с ближайшими сплошными линиями диаграммы состояния. Такая горизонталь называется конода. Точка пересечения коноды с линией ликвидуса (AmB) b характеризует состав жидкой фазы; точка пересечения с линией солидуса (AnB) c характеризует состав твердой фазы; т.е. в точке a в термодинамическом равновесии сосуществуют жидкость, содержащая примерно 10 % В + 90 % А, и твердая фаза, содержащая 45 % В + 55 % А.
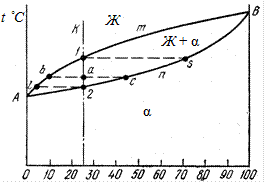
Рис. 25. Построение конод для применения правила отрезков
Относительное содержание жидкой и твердой фаз характеризуется противолежащими к ним отрезками: жидкая характеризуется отрезком ac, а твердая – ba, поэтому отношение жидкой к твердой фазе выражается дробью: ж/тв = ac / ba. Отрезок bс характеризует все 100 % сплава, поэтому доля жидкой фазы равна: ж/(ж+тв) = ac / bc, а твердой – тв/(ж+тв) = ba / bc.
Из правила отрезков также следует, что по мере охлаждения химический состав твердой и жидкой фазы непрерывно изменяются. Так, например, в точке 1, отвечающей началу кристаллизации, в равновесии находятся жидкая фаза, содержащая примерно 25 % В + 75 % А, и зародыши твердой фазы, содержащие 70 % В + 30 % А; а в точке 2, отвечающей окончанию кристаллизации, в равновесии находятся остатки жидкой фазы, содержащие 5 % В + 95 % А, и твердая фаза, содержащая примерно 25 % В + 75 % А.
Таким образом, первые порции образующейся твердой фазы обогащены более тугоплавким компонентом. Однако при очень медленном охлаждении процессы диффузии в жидкой и твердой фазах (объемная диффузия), а также процессы взаимной диффузии между ними (межфазная диффузия) успевают за процессом кристаллизации, поэтому состав кристаллов по всему объему затвердевшего сплава выравнивается.
 2014-02-18
2014-02-18 26178
26178
