Катализатор активно, за счет химических связей (ковалентных, ионных, водородных) или электростатического взаимодействия, участвует в элементарном акте реакции. Он образует либо промежуточное соединение с одним из участников реакции (многостадийный процесс), либо активированный комплекс со всеми реагирующими веществами (одностадийный процесс). После каждого элементарного акта он регенерируется и может вступать во взаимодействие с новыми молекулами реагирующих веществ.
Таким образом, в ходе каталитической реакции катализатор остается химически неизменным, а его количество постоянным (если не учитывать механического уноса и возможности протекания побочных процессов, в которых катализатор участвует как реагент).
Различают также гомогенный и гетерогенный катализ.
При гомогенном катализе исходные вещества и катализатор находятся в одинаковом агрегатном состоянии. Скорость такой реакции зависит не только от наличия или отсутствия катализатора, но и от его концентрации в системе.
При гетерогенном катализе исходные вещества находятся в разных агрегатных состояниях. Чаще всего катализатор является твердым веществом, а реагенты – жидкостью или газом. Скорость такой реакции зависит от площади поверхности катализатора.
Механизм воздействия гомогенного и гетерогенного катализа в общих чертах схож. И в том и в другом случае катализаторы уменьшают энергию активации реакции, причем сам катализатор принимает участие в образовании активированного комплекса. Энергия активации такого комплекса меньше, чем Еа комплекса без катализатора, поэтому скорость реакции растет.
При распаде активированного комплекса катализатор высвобождается, и в реакции, таким образом, не расходуется. Но в деталях механизм действия гомогенного и гетерогенного катализа различается.
Механизм гомогенного катализа обычно объясняют с помощью теории промежуточных соединений. Согласно этой теории, катализатор (K) сначала образует с одним из исходных веществ промежуточное соединение АK, которое реагирует с другим исходным веществом с восстановлением катализатора. Схематически это можно представить так:
А + Б = АБ (реакция протекает медленно в отсутствии катализатора)
В присутствии катализатора процесс разбивается на 2 стадии:
1) А + K = АK (протекает быстро)
2) АK + Б = АБ + К (протекает быстро)
Энергия активации каждой из этих двух стадий меньше энергии активации некаталитической реакции (рис. 46).
Конкретным примером гомогенного катализа может служить реакция окисления SO2 в SO3 в присутствии катализатора NO.
Без катализатора реакция даже при нагревании практически не идет:
2SO2 + O2  2SO3
2SO3
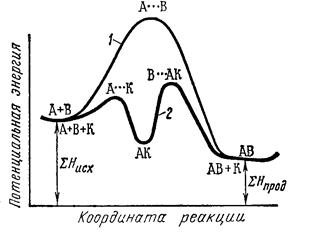
Рис. 46. Энергетическая схема хода реакции: 1 – без катализатора; 2 – в присутствии катализатора
В присутствии NO её скорость существенно возрастает, но сама реакция протекает в 2 этапа:
1) 2NO + O2 = 2NO2
2) NO2 + SO2 = SO3 + NO
В гетерогенном катализе важнейшую роль играет адсорбция.
Поверхность твёрдого катализатора является неоднородной. На ней выделяют так называемые активные центры. Они возникают в тех местах поверхности катализатора, где атомы или ионы слабее всего связаны с кристаллической решеткой, т.е. там, где силовое поле наименее насыщено: выступы или пики на поверхности, ребра граней кристаллов. Таких активных центров как правило мало. Они составляют всего лишь 0,1% от поверхности катализатора.
 2014-02-09
2014-02-09 10469
10469
