Химические свойства.
Способы получения.
1. Восстановление нитросоединений:
R-NO2 + 3H2 ¾¾® R-NH2 + 2H2O
Для восстановления нитросоединений используют катализаторы Pt, Pd, Ni.
Восстановление ароматических нитросоединений – реакция Зинина.
В качестве восстановителя могут быть использованы Н2, Fe и Sn в HCl, сульфиды щелочных металлов.
2. Аммонолиз и аминолиз галогенпроизводных:
А) алифатические амины (оммонолиз – реакция Гофмана):
Механизм реакции SN2
СН3I +:NH3 ¾¾® CH3NH3+I- ¾¾® CH3NH2 + HI
иодид метиламмония
Образовавшийся первичный амин является более сильным нуклеофилом, чем NH3, благодаря положительному индуктивному влиянию алкильного радикала, увеличивающего электронную плотность на азоте, поэтому далее идет аминолиз:
CH3NH2 + СН3I ¾¾® (СН3)2NH2+I- ¾¾® (СН3)2NH + HI
иодид диметиламмония
(СН3)2NH + СН3I ¾¾® (СН3)3NH+I- ¾¾® (СН3)3N + HI
иодид триметиламмония
Б) ароматические амины:
С6Н5Cl + NH3 ¾¾® С6Н5NH2 + HСl
С6Н5Cl + С6Н5NH2 ¾¾® С6Н5-NH-С6Н5 + HСl (дифениламин)
С6Н5-NH-С6Н5 + С6Н5Cl ¾¾® (С6Н5)3N + HСl (трифениламин)
3. Восстановление нитрилов:
Ni H2
R-CºN + H2 ¾¾® R-CН=NH ¾¾® R-CH2-NH2
имин амин
4. Восстановление амидов карбоновых кислот:
СН3-С=О + H2 ¾¾® СН3-СH2-NH2 + H2O
ï
NH2
5. Расщепление амидов карбоновых кислот по Гофману:
СН3-С=О + NaOBr ¾¾® СН3-NH2 + CO2 + NaBr
ï
NH2
6. Восстановительное аминирование карбонильных соединений:
H2, Ni
R-CНО + NH3 ¾¾® R-CН=NH ¾¾® R-CH2-NH2
7. Декарбоксилирование аминокислот (реакция проходит в живых организмах под действием ферментов):
R-CН-СООН ¾¾® R-CH2-NH2 + СО2
ï
NH2
Амины по химическим свойствам во многом напоминают NH3. В молекулах алифатических аминов атом азота находится в состоянии sp3-гибридизации, поэтому они, подобно NH3, имеют пирамидальную конфигурацию. Из-за наличия неподеленой пары электронов на атоме азота все амины являются полярными соединениями. Поэтому первичные и вторичные амины образуют межмолекулярные водородные связи:
СН3 СН3 СН3
ï ï ï
Н-N:... Н-N:... Н-N:...
ï ï ï
H H H
Низшие алифатические амины легко растворимы в воде, что также обусловлено образованием водородных связей с молекулами воды. Ароматические амины плохо растворимы в воде.
Амины, как и NH3, проявляют основные свойства, что обусловлено наличием неподеленной пары электронов на атоме азота. При взаимодействии с кислотами амины превращаются в аммониевые соли:
СН3NH2 +НСl ¾¾® СН3NH3+ Cl- хлорид метиламмония
Соли аминов гидролитически устойчивы, хорошо растворимы в воде, легко кристаллизуются из водных растворов. Многие лекарственные вещества, относящиеся к классу аминов, применяются в виде солей с минеральными или органическими кислотами.
Алифатические амины – сильные основания. Водные растворы аминов имеют щелочную среду по лакмусу:
СН3 СН3
ï ï
 |
СН3-N: + Н2О СН3-N+-Н ОН-
ï ï
СH3 СH3
Основность ароматических аминов существенно ниже, чем у аминов алифатических. Это объясняется тем, что неподеленная пара электронов атома азота вступает в р,p- сопряжение с электронами бензольного кольца:
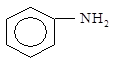
Заместители в кольце влияют на основность аминов: электронодонорные заместители ее увеличивают, а электроноакцепторные снижают.
 2014-02-09
2014-02-09 827
827








